10+ Macam Ikatan Kimia, Proses Pembentukan dan Contohnya Bagian 2
https://blogmipa-kimia.blogspot.com/2018/05/macam-macam-ikatan-kimia-2.html
Daftar Materi Kimia
Advertisement
Baca Juga:
#5 Ikatan Kovalen Koordinasi
Apa itu Ikatan Kovalen Koordinasi?
Ikatan kovalen koordinasi adalah ikatan kovalen yang terjadi karena pasangan elektron ikatan (PEI) yang dipakai bersama hanya berasal dari salah satu atom yang berikatan. Dengan kata lain satu atom menyumbangkan elektron valensi sedangkan atom yang lain tidak menyumbangkan elektron.
Karena kita tahu bahwa dalam satu senyawa bisa terdapat lebih dari satu jenis ikatan kovalen, maka untuk membedakan ikatan kovalen koordinasi dengan ikatan kovalen yang lain, ikatan kovalen koordinat diberi simbol atau lambang khusus. Jika biasanya ikatan kovalen dinyatakan dengan garis, maka ikatan kovalen koordinasi dinyatakan dengan anak panah. Perhatikan notasi ikatan kovalen berikut.
A : + B = A : B atau A → B
|
Tanda (→) menyatakan sumber pasangan elektron yang dipakai bersama, yaitu berasal dari A. Dengan demikian ikatan A → B dinamakan ikatan kovalen koordinasi. Ikatan kovalen koordinat dapat terjadi antara suatu atom atau molekul yang memiliki pasangan elektron bebas (PEB) dan sudah mencapai konfigurasi oktet dengan atom atau molekul lain yang membutuhkan dua elektron dan belum mencapai konfigurasi oktet.
Proses Pembentukan Ikatan Kovalen Koordinasi
Berikut ini adalah proses pembentukan ikatan kovalen koordinasi pada senyawa HNO2.
Senyawa HNO2 tersusun atas satu atom H dan satu atom N dan dua atom O dengan konfigurasi elektron sebagai berikut:
1H
|
=
|
1
|
(memerlukan 1 elektron untuk mencapai kaidah duplet)
|
7N
|
=
|
2, 5
|
(memerlukan 3 elektron untuk mencapai kaidah oktet)
|
8O
|
=
|
2, 6
|
(memerlukan 2 elektron untuk mencapai kaidah oktet)
|
Untuk mencapai kestabilannya, atom H memerlukan 1 elektron valensi, atom N memerlukan 3 elektron valensi dan atom O memerlukan 2 elektron valensi. Dengan demikian, ikatan yang mungkin terjadi adalah:
□ atom N memasangkan 1 elektron kepada satu atom H dan atom H juga memasangkan 1 elektron valensi kepada N. Atom H sudah duplet, tetapi atom N kurang 2 elektron lagi untuk menjadi stabil (jumlah elektron valensi N = 6)
□ lalu atom N memasangkan 2 elektron kepada satu atom O dan atom O juga memasangkan 2 elektron kepada atom N. Atom O sudah stabil, begitu juga dengan atom N juga sudah oktet (jumlah elektron valensi N = 8)
□ akan tetapi, pada senyawa HNO2 terdapat dua atom O yang berikatan sedangkan atom N sudah stabil. Lalu bagaimana caranya atom N mengikat satu atom O lagi agar keduanya sama-sama oktet? Atom N memang sudah stabil, namun atom N masih memiliki 1 pasang elektron bebas (PEB), dimana PEB ini dapat berikatan dengan atom lain dengan membentuk ikatan kovalen koordinat.
Dengan demikian atom N memasangkan dua elektronnya kepada satu atom O yang lain dan atom O tersebu tidak memasangkan elektron valensinya sehingga keduanya sama-sama oktet. Dalam struktur lewis, proses pembentukan senyawa HNO2 digambarkan sebagai berikut:
Dari gambar struktur lewis senyawa HNO2 di atas, terlihat bahwa dalam senyawa asam nitrit tersebut terdapat tiga jenis ikatan kovalen, yaitu ikatan kovalen tuggal antara atom N dengan atom H, ikatan kovalen rangkap dua antara atom N dengan atom O dan ikatan kovalen koordinasi antara atom N dengan atom O satunya.
#6 Ikatan Kovalen Polar dan Nonpolar
Apa itu Ikatan Kovalen Polar dan Nonpolar?
■ Ikatan kovalen polar adalah ikatan yang pasangan elektron ikatannya cenderung tertarik ke salah satu atom yang berikatan. Ikatan kovalen polar terbentuk antara atom-atom unsur yang memiliki perbedaan nilai keelektronegatifan yang relatif besar.
■ Ikatan kovalen nonpolar adalah ikatan yang pasangan elektron ikatannya tertarik sama kuat ke arah atom-atom yang berikatan. Ikatan kovalen nonpolar terbentuk antara atom-atom unsur yang memiliki perbedaan nilai keelektronegatifan yang kecil atau sama dengan nol serta tidak memiliki pasangan elektron ikatan.
Perbedaan Ikatan Kovalen Polar dan Nonpolar
Karakteristik
|
Senyawa Kovalen Polar
|
Senyawa Kovalen Nonpolar
|
Perbedaan Kelektronegatifan
|
Relatif Besar
|
Sangat Kecil atau nol untuk senyawa biatom sejenis
|
Pasangan Elektron Ikatan (PEI)
|
Cenderung tertarik ke salah satu atom yang berikatan
|
Tertarik sama kuat oleh atom-atom yang berikatan
|
Pasangan Elektron Bebas (PEB)
|
Atom pusat memiliki PEB
|
Atom pusat tidak memiliki PEB
|
Bentuk Molekul
|
Asimetris (mengutub)
|
Simetris (proporsional)
|
Daya Hantar Listrik
|
Dapat mampu menghantarkan listrik
|
Tidak dapat menghantarkan listrik
|
Momen Dipol
|
Lebih dari nol
|
Sama dengan nol
|
Kelarutan
|
Umumnya hanya dapat larut dalam cairan polar lainnya
|
Umumnya hanya dapat larut dalam cairan nonpolar lainnya
|
Contoh Ikatan Kovalen Polar dan Nonpolar
Untuk lebih memahami ikatan kovalen polar dan nonpolar pada suatu senyawa, perhatikan ilustrasi berikut ini.
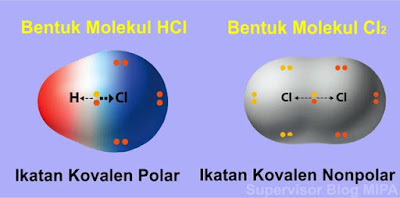
Pada contoh ikatan kovalen polar yaitu pada molekul HCl, pasangan elektron ikatan (PEI) cenderung tertarik ke salah satu atom yang memiliki elektronegativitas lebih besar yaitu atom Cl oleh karena itu bentuk molekulnya mengutub pada atom Cl sehingga menjadi asimetris (tidak simetris). Kepolaran pada molekul ini terjadi karena antara atom H dan atom Cl memiliki perbedaan keelektronegatifan yang relatif besar.
Sedangkan pada contoh ikatan kovalen nonpolar yaitu molekul Cl2, pasangan elektron ikatan tertarik sama kuat ke arah atom-atom yang berikatan. Hal ini dikarenakan antara dua atom Cl memiliki keelektronegatifan yang sama besar atau dengan kata lain perbedaan elektronegativitas adalah nol. Karena PEI tertarik sama kuat, maka bentuk molekul pada senyawa Cl2 adalah simetris.
Cara Menentukan Jenis Ikatan Kovalen Polar atau Nonpolar
Tentukan jenis ikatan kovalen, apakah polar atau nonpolar pada senyawa-senyawa berikut ini.
NH3, HF, H2O dan CH4
Untuk menentukan jenis ikatan kovalen polar atau nonpolar pada senyawa poliatom di atas dapat digunakan beberapa langkah sebagai berikut:
1
|
Menentukan atom pusat
|
2
|
Menggambarkan struktur lewis
|
3
|
Menentukan ada tidaknya PEB
|
4
|
Jika ada PEB berarti polar, jika tidak ada berarti nonpolar
|
5
|
Untuk semua ikatan hidrogen, merupakan senyawa polar
|
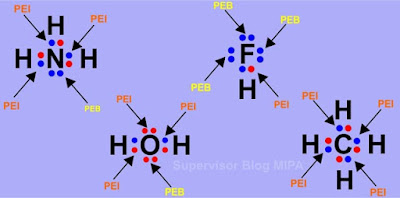
Gambar struktur lewis dari keempat senyawa di atas adalah sebagai berikut:
Dari gambar struktur lewis di atas maka senyawa yang berikatan kovalen polar adalah senyawa NH3, HF dan H2O sedangkan senyawa yang berikatan kovalen nonpolar adalah CH4.
#7 Ikatan Logam
Apa itu Ikatan Logam?
Ikatan logam adalah ikatan yang terbentuk akibat adanya gaya tarik-menarik yang terjadi antara ion-ion positif dengan elektron-elektron pada kulit terluar (valensi) dari suatu atom unsur logam, seperti emas, perak, perunggu, tembaga, kuningan, besi, aluminium, timah, dan sebagainya.
Elektron-elektron pada atom logam dapat bebas bergerak karena atom logam mempunyai sedikit elektron valensi sehingga sangat mudah untuk dilepaskan membentuk ion positif. Oleh karena itu, kulit terluar atom logam relatif longgar (banyak tempat kosong) sehingga elektron dapat berpindah dari satu atom ke atom yang lain.
Proses Pembentukan Ikatan Logam
Salah satu teori yang dapat menjelaskan proses pembentukan ikatan logam adalah teori lautan elektron. Teori ikatan logam ini pertama kali dikembangkan oleh Drude (1902) kemudian diuraikan oleh Lorentz (1916) sehingga dikenal dengan teori elektron bebas atau teori lautan elektron dari Drude-Lorentz. Namun ada juga yang menyebut teori lautan elektron dengan teori awan elektron.
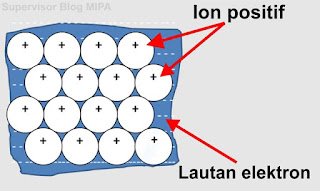
Menurut teori ini, kristal logam tersusun atas ion-ion positif yang terpateri di tempat (tidak bergerak) dikelilingi oleh lautan elektron valensi yang bergerak bebas dalam kisi kristal logam. Perhatikan gambar berikut ini.
Elektron-elektron valensi logam bergerak bebas dan mengisi ruang-ruang di antara kisi-kisi kation logam yang bermuatan positif. Gaya elektrostatistik antar muatan (+) logam dan muatan (−) dari elektron akan menggabungkan kisi-kisi logam tersebut. Tarik menarik dari kation di dalam lautan elektron yang bertindak sebagai perekat dan menggabungkan kation-kation inilah yang menyebabkan terbentuknya ikatan logam.
#8 Ikatan Hidrogen
Ikatan hidrogen merupakan ikatan yang terbentuk antara unsur H dengan atom F, O dan N. ikatan hidrogen jauh lebih lemah dari ikatan kovalen maupun ikatan ion. Ikatan hidrogen adalah jenis ikatan intermolekul (antarmolekul) dan bukan ikatan intramoleku (di dalam molekul).
Ikatan Hidrogen = Unsur H + F atau O atau N
|
Contoh senyawa yang berikatan hidrogen adalah air (H2O), NH3, HF dan sebagainya.
#9 Ikatan Van Der Waals
Ikatan Van der Waals merupakan ikatan yang dimiliki oleh gas-gas mulia yang mengalami proses kondensasi, sehingga fasenya berubah menjadi fase cair pada saat temperaturnya mencapai temperatur yang sangat rendah. Ikatan Van der Waals merupakan ikatan yang lebih lemah jika dibandingkan dengan ikatan kovalen, ion dan ikatan logam.
Ikatan Van Der Waals = Unsur Gas Mulia Berwujud Cair
|
Dalam fasa gas, masing-masing atom gas mulia dapat berdiri dengan bebas dan stabil tanpa terikat oleh atom-atom yang lain. Namun demikian, pada saat mengalami proses kondensasi, maka atom-atom tersebut akan saling terikat oleh gaya yang relatif lemah yang disebut sebagai gaya Van der Waals.
Molekul terbentuk dari atom-atom yang memiliki elektron-elektron dan proton yang muatannya berlawanan. Akibat muatan berbeda ini, maka jika dua molekul berdekatan akan timbul gaya tarik menarik yang bersumber dari gaya tarik antara inti atom yang bermuatan positif dari molekul yang satu dengan elektron-elektron yang dimiliki oleh molekul lainnya. Keadaan ini menyebabkan ikatan yang terjadi relative lemah. Contoh ikatan Van Der Waals terdapat pada senyawa CH4, Br2 dan I2.