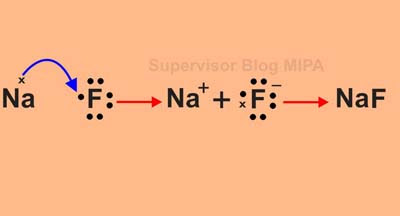10+ Macam Ikatan Kimia, Proses Pembentukan dan Contohnya Bagian 1
https://blogmipa-kimia.blogspot.com/2018/05/macam-macam-ikatan-kimia-1.html
Daftar Materi Kimia
Advertisement
Baca Juga:
Ikatan kimia adalah gaya yang mengikat atom-atom atau ion-ion dalam suatu molekul atau senyawa. Konsep tentang ikatan kimia pertama kali dikemukakan pada tahun 1916 oleh Gilbert Newton Lewis dari Amerika dan Albrecht Kossel dari Jerman. Penemuan konsep tentang ikatan kimia ini didasari dari beberapa kenyataan tentang sifat-sifat atom dalam unsur yaitu sebagai berikut:
□ Kenyataan bahwa unsur gas mulia (golongan VIIIA) yaitu he, Ne, Ar, Kr, Xe dan Rn sukar membentuk senyawa. Hal ini mengindikasikan bahwa unsur gas mulia memiliki susunan elektron yang stabil.
□ Setiap atom mempunyai kecenderungan untuk memiliki susunan elektron yang stabil seperti gas mulia. Caranya dengan melepaskan elektron atau menangkap elektron dari unsur lain.
□ Untuk memperoleh susunan elektron yang stabil hanya dapat dicapai dengan cara berikatan dengan atom lain, yaitu dengan cara melepaskan elektron, menangkap elektron, maupun pemakaian elektron secara bersama-sama.
Ikatan kimia dibedakan menjadi 8 macam, yaitu ikatan ion, ikatan kovalen yang dibedakan menjadi 5 jenis (tunggal, rangkap dua, rangkap tiga, koordinasi, polar, nonpolar), ikatan logam, ikatan hidrogen dan ikatan Van Der Waals. Nah berikut ini penjelasan kedelapan jenis ikatan kimia tersebut. Silahkan kalian simak baik-baik.
#1 Ikatan Ion
Apa itu Ikatan Ion?
Ikatan ion adalah ikatan yang terbentuk karena adanya serah terima elektron atau perpindahan elektron dari satu atom ke atom lainnya. Atom yang menyerahkan/melepas elektron membentuk ion positif sedangkan atom yang menerima/menangkap elektron membentuk ion negatif, sehingga timbul gaya elektrostatik antara kedua ion yang bermuatan.
Jadi pada dasarnya atom-atom membentuk ikatan ion karena masing-masing ingin mencapai kesetimbangan/kestabilan seperti struktur elektron gas mulia (kaidah oktet). Ikatan ion dapat terbentuk antara:
1
|
Ion positif dengan ion negatif.
|
2
|
Atom-atom berenergi ionisasi kecil (atom unsur golongan IA IIA dan IIIA) dengan atom-atom berafinitas elektron besar (atom unsur golongan VA, VIA dan VIIA).
|
3
|
Atom-atom dengan kelektronegatifan kecil dengan atom-atom yang memiliki keelektronegatifan besar.
|
Karena unsur golongan IA, IIA dan IIIA merupakan unsur logam sedangkan unsur golongan VA, VIA dan VIIA merupakan unsur nonlogam jadi bisa dikatakan bahwa ikatan ion adalah ikatan antara unsur logam dengan unsur nonlogam.
Ikatan Ion = Unsur Logam + Unsur Nonlogam
|
Proses Pembentukan Ikatan Ion
Sebagaimana telah diuraikan di atas, ikatan ion terjadi antara ion positif dengan ion negatif karena adanya gaya tarik-menarik elektrostatik. Syarat terjadinya ikatan ion adalah salah satu atom mampu melepaskan elektron (tanpa memerlukan banyak energi) dan atom yang lain mampu menerima elektron.
Senyawa yang terjadi karena ikatan ion disebut dengan senyawa ion. Berikut ini adalah contoh proses pembentukan ikatan ion antara atom 11Na dan 9F dalam NaF.
Konfigurasi elektron Na dan F adalah:
Na
|
:
|
2, 8, 1
|
(melepas 1 elektron)
|
membentuk
|
Na+
|
F
|
:
|
2, 7
|
(menerima 1 elektron)
|
membentuk
|
F−
|
Proses pembentukan ikatan adalah sebagai berikut:
Na
|
→
|
Na+ + e
|
F + e
|
→
|
F−
|
Na + F
|
→
|
Na+ + F−
|
→
|
NaF
|
Dengan menggunakan struktur lewis, proses pembentukan NaF dapat digambarkan sebagai berikut:
Contoh Senyawa yang Berikatan Ion
Berikut ini adalah tabel contoh senyawa ion beserta jenis dan golongan unsur penyusun senyawa tersebut.
Senyawa Ion
|
Unsur Penyusun
| |||||
Logam
|
Nonlogam
| |||||
IA
|
IIA
|
IIIA
|
VA
|
VIA
|
VIIA
| |
K2O
|
√
|
√
| ||||
CaO
|
√
|
√
| ||||
Al2O3
|
√
|
√
| ||||
NaCl
|
√
|
√
| ||||
MgCl2
|
√
|
√
| ||||
AlCl3
|
√
|
√
| ||||
MgO
|
√
|
√
| ||||
NaF
|
√
|
√
| ||||
Na2O
|
√
|
√
| ||||
CaF2
|
√
|
√
| ||||
Li2O
|
√
|
√
| ||||
AlF3
|
√
|
√
| ||||
CaCl2
|
√
|
√
| ||||
KCl
|
√
|
√
| ||||
SrO
|
√
|
√
| ||||
MgBr2
|
√
| |||||
SrCl2
|
√
|
√
| ||||
#2 Ikatan Kovalen
Apa itu Ikatan Kovalen
Ikatan kovalen adalah ikatan yang terbentuk karena adanya pemakaian bersama pasangan elektron oleh atom-atom antar sesama unsur nonlogam yang berikatan. Ikatan kovalen terjadi akibat ketidakmampuan salah satu atom yang akan berikatan untuk melepaskan elektron menjadi ion positif khususnya terjadi pada atom nonlogam yang cenderung menerima elektron.
Ikatan kovalen terbentuk diantara dua atom yang sama-sama ingin menangkap elektron. Dua atom unsur nonlogam saling menyumbangkan elektron agar tersedia satu atau lebih pasangan elektron yang dijadikan milik bersama. Artinya, pasangan elektron ditarik oleh inti kedua atom yang berikatan.
Ikatan Kovalen = Unsur Nonlogam + Unsur Nonlogam
|
Proses Pembentukan Ikatan Kovalen
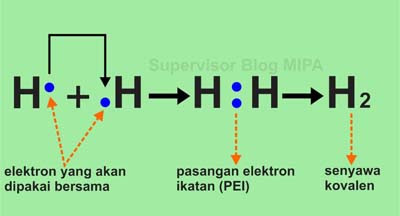
Berikut ini adalah contoh proses pembentukan ikatan kovalen dari senyawa H2.
Konfigurasi elektron dari 1H = 1
Atom H akan stabil jika mengikat satu elektron membentuk konfigurasi mirip dengan atom He (2). Satu elektron ini dapat diperoleh dengan cara saling memasangkan elektron dari dua atom H, sehingga dengan menggunakan rumus lewis, pembentukan senyawa H2 digambarkan sebagai berikut:
Pada gambar struktur lewis H2 di atas, setiap atom H memiliki dua elektron valensi (seperti He) yang digunakan secara bersama-sama. Dua elektron valensi ini disebut dengan pasangan elektron ikatan (PEI). Karena molekul H2 sudah mencapai kaidah duplet maka molekul ini sudah stabil.
Contoh Senyawa yang Berikatan Kovalen
Berikut ini adalah tabel contoh senyawa kovalen beserta jenis dan golongan unsur penyusun senyawa tersebut.
Senyawa Kovalen
|
Unsur Penyusun
| ||||
Nonlogam
| |||||
IA
|
IVA
|
VA
|
VIA
|
VIIA
| |
O2
|
√√
| ||||
Cl2
|
√√
| ||||
H2
|
√√
| ||||
Br2
|
√√
| ||||
F2
|
√√
| ||||
I2
|
√√
| ||||
N2
|
√√
| ||||
H2O
|
√
|
√
| |||
HCl
|
√
|
√
| |||
HF
|
√
|
√
| |||
ClF
|
√√
| ||||
IF
|
√√
| ||||
ICl
|
√√
| ||||
Hbr
|
√
|
√
| |||
HI
|
√
|
√
| |||
SO2
|
√√
| ||||
SO3
|
√√
| ||||
CH4
|
√
|
√
| |||
C6H6
|
√
|
√
| |||
C2H4
|
√
|
√
| |||
C3H8
|
√
|
√
| |||
NH3
|
√
|
√
| |||
NH4+
|
√
|
√
| |||
CO2
|
√
|
√
| |||
CO
|
√
|
√
| |||
NO
|
√
|
√
| |||
CCl4
|
√
|
√
| |||
PBr3
|
√
|
√
| |||
NBr3
|
√
|
√
| |||
SCl2
|
√
|
√
| |||
P2S3
|
√
|
√
| |||
PCl3
|
√
|
√
| |||
PCl5
|
√
|
√
| |||
HNO2
|
√
|
√
|
√
| ||
HNO3
|
√
|
√
|
√
| ||
NH4Cl
|
√
|
√
|
√
| ||
H2SO4
|
√
|
√√
| |||
#3 Ikatan Kovalen Tunggal
Apa itu Ikatan Kovalen Tunggal?
Ikatan kovalen tunggal adalah ikatan yang terbentuk dari penggunaan bersama satu pasang elektron (setiap atom yang berikatan memberikan satu elektron valensi untuk digunakan secara bersama-sama). Dengan demikian jumlah PEI adalah satu.
Proses Pembentukan Ikatan Kovalen Tunggal
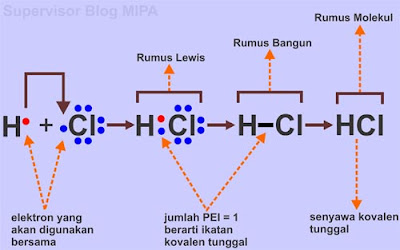
Berikut ini adalah contoh proses pembentukan ikatan kovalen tunggal pada senyawa asam klorida dengan rumus kimia HCl.
Senyawa HCl tersusun atas satu atom H dan satu atom Cl dengan konfigurasi elektron sebagai berikut:
1H
|
=
|
1
|
(memerlukan 1 elektron untuk mencapai kaidah duplet)
|
17Cl
|
=
|
2, 8, 7
|
(memerlukan 1 elektron untuk mencapai kaidah oktet)
|
Untuk mencapai kestabilannya, masing-masing atom H dan Cl memerlukan 1 elektron. Jadi 1 atom H akan berpasangan dengan 1 atom Cl. Jika digambarkan dengan struktur lewis maka pembentukan ikatan kovalen tunggal pada senyawa HCl adalah sebagai berikut:
Perhatikan gambar struktur lewis pada proses pembentukan senyawa HCl di atas. jumlah pasangan elektron yang digunakan bersama (PEI) antara atom H dan Cl adalah 1 pasang yang digambarkan dalam bentuk satu garis rumus bangun lewis dimana satu garis mewakili satu pasang elektron. Karena jumlah PEI adalah satu maka senyawa HCl dikatan berikatan secara kovalen tunggal.
#4 Ikatan Kovalen Rangkap (2 dan 3)
Apa itu Ikatan Kovalen Rangkap?
Ikatan kovalen rangkap adalah ikatan kimia yang terbentuk dari penggunaan bersama dua atau tiga pasang elektron (setiap atom yang berikatan memberikan dua atau tiga elektron valensi untuk digunakan secara bersama-sama). Dengan demikian jumlah PEI adalah dua atau tiga. Jika PEI dua, maka ikatannya disebut ikatan kovalen rangkap dua. Dan Jika PEI tiga, maka ikatannya disebut ikatan kovalen rangkap tiga.
Proses Pembentukan Ikatan Kovalen Rangkap
■ Proses Pembentukan Ikatan Kovalen Rangkap 2 pada Senyawa CO2
Senyawa CO2 tersusun atas satu atom C dan dua atom O dengan konfigurasi elektron sebagai berikut:
6C
|
=
|
2, 4
|
(memerlukan 4 elektron untuk mencapai kaidah oktet)
|
8O
|
=
|
2, 6
|
(memerlukan 2 elektron untuk mencapai kaidah oktet)
|
Untuk mencapai kestabilannya, atom C cenderung menerima 4 elektron, sedangkan atom O cenderung menerima 2 elektron. Jika atom C dan O saling berikatan, 1 atom C harus menyumbangkan 4 elektron untuk digunakan bersama. Adapun atom O harus menyumbangkan 2 elektron.
Berapakah jumlah atom O yang harus diikat oleh atom C? jika hanya 1 atom O, atom O telah memenuhi kaidah oktet. Akan tetapi, atom C masih kekurangan 2 elektron. Agar memenuhi kaidah oktet, atom C harus mengikat 1 atom O lagi sehingga jumlah atom O yang diikat berjumlah 2 buah.
Pada keadaan ini, atom C dan O sama-sama memenuhi kaidah oktet (mencapai kestabilan). Dengan menggunakan struktur lewis, proses pembentukan ikatan kovalen rangkap dua pada senyawa CO2 adalah sebagai berikut
Pada gambar struktur lewis dalam proses pembentukan senyawa CO2 di atas, 2 atom O masing-masing berikatan dengan atom C dengan menggunakan 2 pasang elektron ikatan (PEI) secara bersama-sama. Dua pasang PEI digambarkan dalam bentuk 2 garis pada masing-masing ikatan antara C dengan O.
Dua garis tersebut mewakili 2 pasang elektron ikatan (4 elektron), karena jumlah pasangan elektron yang digunakan bersama ada 2 pasang maka senyawa karbon dioksida (CO2) berikatan secara kovalen rangkap dua.
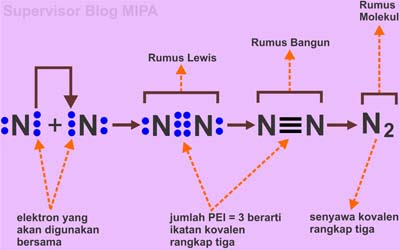
■ Proses Pembentukan Ikatan Kovalen Rangkap 3 pada Molekul N2
Molekul N2 tersusun atas dua atom N dengan konfigurasi elektron sebagai berikut:
7N
|
=
|
2, 5
|
(memerlukan 3 elektron untuk mencapai kaidah oktet)
|
Berdasarkan konfigurasi elektron atom N di atas, maka atom N akan stabil jika konfigurasi elektronnya serupa dengan 10Ne = 2, 8. Agar stabil maka atom N memerlukan 3 elektron tambahan. Kedua elektron tambahan tersebut dapat diperoleh jika dua atom N saling berikatan dimana setiap atom N menyumbangkan 3 elektron untuk digunakan bersama sehingga masing-masing atom N mencapai kaidah oktet.
Proses pembentukan ikatan kovalen rangkap tiga pada molekul N2 dapat digambarkan dalam struktur lewis sebagai berikut
Perhatikan gambar struktur lewis pada proses pembentukan molekul N2 di atas. Jumlah pasangan elektron yang digunakan bersama (PEI) antara dua atom N adalah 3 pasang (6 elektron) yang digambarkan dalam bentuk tiga garis rumus bangun lewis dimana tiga garis mewakili tiga pasang elektron. Karena jumlah PEI adalah tiga maka molekul N2 dikatakan berikatan secara kovalen rangkap tiga.