Penggunaan Bilangan Oksidasi pada Reaksi Redoks, Contoh Soal dan Pembahasan
https://blogmipa-kimia.blogspot.com/2018/04/penggunaan-biloks-pada-reaksi-redoks.html?m=0
Daftar Materi Kimia
Advertisement
Baca Juga:
Reaksi redoks merupakan kegiatan dari reaksi oksidasi dan reduksi. Reaksi redoks sangat mudah dijumpai dalam kehidupan sehari-hari. Perkaratan besi, perubahan warna daging apel menjadi kecokelatan kalau dikupas merupakan contoh peristiwa oksidasi. Konsep reaksi redoks dapat ditinjau dari penggabungan dan pelepasan oksigen, pelepasan dan penerimaan elektron, dan berdasarkan perubahan bilangan oksidasi.
Nah, pada kesempatan kali ini kita akan mempelejari tentang penggunaan bilangan oksidasi (biloks) pada reaksi redoks (reduksi oksidasi). Namun sebelum itu, kita ulas kembali mengenai pengertian bilangan oksidasi dan aturan penentuannya. Untuk itu, silahkan kalian simak baik-baik penjelasan berikut ini.
Apa itu Bilangan Oksidasi?
Bilangan oksidasi adalah suatu bilangan yang menyatakan valensi atom dalam suatu senyawa yang dapat memiliki harga positif maupun negatif atau bilangan yang menunjukkan ukuran kemampuan suatu atom untuk melepas atau menangkap elektron dalam pembentukan suatu senyawa.
Nilai bilangan oksidasi menunjukkan banyaknya elektron yang dilepas atau ditangkap, sehingga bilangan oksidasi dapat bertanda positif maupun bertanda negatif. Bilangan oksidasi positif berarti melepas elektron, sedangkan bilangan oksidasi negatif berarti menyerap atau menangkap elektron.
Bagaimana Cara Menentukan Bilangan Oksidasi?
Bilangan oksidasi atau tingkat oksidasi diterangkan berdasarkan komposisi senyawa, keelektronegatifan relatif unsur, dan menurut beberapa aturan. Aturan untuk menentukan bilangan oksidasi unsur adalah sebagai berikut.
□ Bilangan oksidasi atom unsur bebas adalah nol. Aturan ini berlaku untuk setiap unsur dalam satuan rumus, misalnya dalam H2, N2, O2, P4, S8, Na, Mg, Fe, dan Al.
□ Bilangan oksidasi hidrogen dalam senyawa = +1, misalnya dalam HCl, NH3, dan H2SO4.
Dalam hidrida logam, bilangan oksidasi hidrogen = –1, misalnya dalam NaH dan CaH2.
□ Bilangan oksidasi oksigen dalam senyawanya sama dengan –2, kecuali dalam peroksida misalnya, H2O2, Na2O2, BaO2 = –1, dan dalam OF2 sama dengan +2.
□ Bilangan oksidasi suatu ion monoatomik sama dengan muatannya, contohnya bilangan oksidasi Na+ = +1, Mg2+ = +2, Al3+ = +3, Cl– = –1, dan S2– = –2.
□ Dalam senyawa, bilangan oksidasi unsur golongan alkali sama dengan +1, dan unsur golongan alkali tanah sama dengan +2.
Contoh:
Bilangan oksidasi K dalam KCl, KMnO4, KHSO4, KClO4 sama dengan +1.
Bilangan oksidasi Ca dalam CaSO4, CaHCO3, CaCl2 sama dengan +2.
□ Jumlah bilangan oksidasi unsur-unsur dalam senyawa sama dengan nol.
Contoh:
Jumlah bilangan oksidasi unsur S dan O dalam SO2 = 0
□ Jumlah bilangan oksidasi unsur-unsur dalam suatu ion yang terdiri atas beberapa unsur sama dengan muatannya.
Contoh:
Jumlah bilangan oksidasi unsur S dan O pada SO42– = –2
Penggunaan Bilangan Oksidasi pada Reaksi Redoks
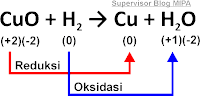
Pada suatu reaksi, perubahan bilangan oksidasi unsur-unsurnya menunjukkan terjadinya reaksi oksidasi dan reduksi. Untuk memahaminya perhatikan reaksi berikut ini.
Pada suatu reaksi, perubahan bilangan oksidasi unsur-unsurnya menunjukkan terjadinya reaksi oksidasi dan reduksi. Untuk memahaminya perhatikan reaksi berikut.
Oksidator
|
:
|
CuO
|
Hasil oksidasi
|
:
|
H2O
| |
Reduktor
|
:
|
H2
|
Hasil reduksi
|
:
|
Cu
|
Bilangan oksidasi Cu pada CuO = +2 dan pada Cu = 0. Bilangan oksidasi Cu mengalami penurunan dari +2 menjadi 0. Bilangan oksidasi H pada H2 = 0 dan pada H2O = +1. Bilangan oksidasi H mengalami kenaikan dari 0 menjadi +1.
Pada reaksi tersebut dinyatakan CuO mengalami reduksi dan H2 mengalami oksidasi. Dengan demikian berdasarkan perubahan bilangan oksidasinya, oksidasi adalah peristiwa kenaikan bilangan oksidasi dan reduksi adalah peristiwa penurunan bilangan oksidasi. Pada reaksi ini CuO bertindak sebagai oksidator. H2 bertindak sebagai reduktor.
Penggunaan bilangan oksidasi pada reaksi redoks lainnya dapat dilihat pada contoh berikut ini.
Contoh 1:
Oksidator
|
:
|
O2
|
Hasil oksidasi
|
:
|
H2O atau H+
| |
Reduktor
|
:
|
H2
|
Hasil reduksi
|
:
|
H2O atau O2-
|
Contoh 2:
Oksidator
|
:
|
HNO3
|
Hasil oksidasi
|
:
|
Cu(NO3)2 atau Cu2+
| |
Reduktor
|
:
|
Cu
|
Hasil reduksi
|
:
|
NO2
|
Dari penjelasan di atas, maka dapat disimpulkan sebagai berikut.
□ Oksidasi adalah peristiwa kenaikan bilangan oksidasi suatu unsur.
□ Reduksi adalah peristiwa penurunan bilangan oksidasi suatu unsur.
□ Oksidator mengalami penurunan bilangan oksidasi.
□ Reduktor mengalami kenaikan bilangan oksidasi.
|
Contoh Soal dan Pembahasan
Jelaskan dengan menggunakan perubahan bilangan oksidasi, peristiwa reduksi dan oksidasi, serta tunjukkan zat oksidator dan zat reduktor pada reaksi berikut.
1. Ca(s) + 2HCl(aq) → CaCl2(aq) + H2(g)
Penyelesaian:
□ Bilangan oksidasi Ca dalam Ca = 0
□ Bilangan oksidasi H dan Cl dalam HCl:
Reaksi penguraian HCl adalah sebagai berikut.
HCl → H+ + Cl-
Jadi, muatan ion dalam HCl adalah:
H+ = 1+ dan Cl− = −1
Karena bilangan oksidasi ion sama dengan jumlah muatannya, maka biloks H = +1 dan biloks Cl = −1.
□ Bilangan oksidasi Ca dan Cl dalam CaCl2:
Reaksi penguraian CaCl2 adalah sebagai berikut.
CaCl2 → Ca2+ + 2Cl-
Jadi, muatan ion dalam CaCl2 adalah:
Ca2+ = 2+ dan Cl− = −1
Karena bilangan oksidasi ion sama dengan jumlah muatannya, maka biloks Ca = +2 dan biloks Cl = −1.
□ Bilangan oksidasi H dalam H2 = 0.
Diagram persamaan reaksi Ca(s) + 2HCl(aq) → CaCl2(aq) + H2(g) beserta bilangan oksidasinya adalah sebagai berikut.
Oksidator
|
:
|
HCl
|
Hasil oksidasi
|
:
|
CaCl2
| |
Reduktor
|
:
|
Ca
|
Hasil reduksi
|
:
|
H2
|
2. Cl2(g) + 2NaBr(aq) → 2NaCl(aq) + Br2(g)
Penyelesaian:
□ Bilangan oksidasi Cl dalam Cl2 = 0.
□ Bilangan oksidasi Na dan Br dalam NaBr:
Reaksi penguraian NaBr adalah sebagai berikut.
NaBr → Na+ + Br-
Jadi, muatan ion dalam NaBr adalah:
Na+ = 1+ dan Br− = −1
Karena bilangan oksidasi ion sama dengan jumlah muatannya, maka biloks Na = +1 dan biloks Br = −1.
□ Bilangan oksidasi Na dan Cl dalam NaCl:
Reaksi penguraian NaCl adalah sebagai berikut.
NaCl → Na+ + Cl-
Jadi, muatan ion dalam NaCl adalah:
Na+ = 1+ dan Cl− = −1
Karena bilangan oksidasi ion sama dengan jumlah muatannya, maka biloks Na = +1 dan biloks Cl = −1.
□ Bilangan oksidasi Br dalam Br2 = 0.
Diagram persamaan reaksi Cl2(g) + 2NaBr(aq) → 2NaCl(aq) + Br2(g) beserta bilangan oksidasinya adalah sebagai berikut.
Oksidator
|
:
|
Cl2
|
Hasil oksidasi
|
:
|
Br2
| |
Reduktor
|
:
|
NaBr
|
Hasil reduksi
|
:
|
NaCl
|
3. Zn(s) + H2SO4(aq) → ZnSO4(aq) + H2(g)
Penyelesaian:
□ Bilangan oksidasi Zn dalam Zn = 0.
□ Bilangan oksidasi H, S dan O dalam H2SO4:
Bilangan oksidasi H = +1
Bilangan oksidasi O = -2
Maka:
⇒ (2 × b.o H) + (b.o S) + (4 × b.o O) = 0
⇒ (2 × 1) + (b.o S) + (4 × -2) = 0
⇒ (2) + (b.o S) + (-8) = 0
⇒ b.o S + (-6) = 0
⇒ b.o S = 6
Jadi, bilangan oksidasi H, S dan O dalam H2SO4 adalah +1, -2, dan +6.
□ Bilangan oksidasi Zn dalam ZnSO4:
Reaksi penguraian ZnSO4 adalah sebagai berikut.
ZnSO4 → Zn2+ + SO42-
Karena bilangan oksidasi ion sama dengan jumlah muatannya, maka biloks Zn = +2.
□ Bilangan oksidasi H dalam H2 = 0.
Diagram persamaan reaksi Zn(s) + H2SO4(aq) → ZnSO4(aq) + H2(g) beserta bilangan oksidasinya adalah sebagai berikut.
Oksidator
|
:
|
H2SO4
|
Hasil oksidasi
|
:
|
ZnSO4
| |
Reduktor
|
:
|
Zn
|
Hasil reduksi
|
:
|
H2
|
4. Fe(s) + Cu2+(aq) → Fe2+ + Cu(s)
Penyelesaian:
□ Bilangan oksidasi Fe = 0.
□ Bilangan Cu2+ = +2.
□ Bilangan Fe2+ = +2.
□ Bilangan oksidasi Cu = 0.
Diagram persamaan reaksi Fe(s) + Cu2+(aq) → Fe2+ + Cu(s) beserta bilangan oksidasinya adalah sebagai berikut.
Oksidator
|
:
|
Cu2+
|
Hasil oksidasi
|
:
|
Fe2+
| |
Reduktor
|
:
|
Fe
|
Hasil reduksi
|
:
|
Cu
|