Model/Teori Atom Rutherford: Pengertian, Gambar, Kekurangan dan Kelebihannya
https://blogmipa-kimia.blogspot.com/2018/04/model-atom-rutherford.html?m=0
Daftar Materi Kimia
Advertisement
Baca Juga:
Antoine Henri Becquerel (1852-1908), seorang ilmuwan dari Perancis pada tahun 1896 menemukan bahwa uranium dan senyawa-senyawanya secara spontan memancarkan partikel-partikel. Partikel yang dipancarkan itu ada yang bermuatan listrik dan memiliki sifat yang sama dengan sinar katode atau elektron.
Unsur-unsur yang memancarkan sinar itu disebut unsur radioaktif, dan sinar yang dipancarkan juga dinamai sinar radioaktif. Ada tiga macam sinar radioaktif, yaitu:
■ sinar alfa (α), yang bermuatan positif
■ sinar beta (β), yang bermuatan negatif
■ sinar gama(γ), yang tidak bermuatan
Sinar alfa dan beta merupakan radiasi partikel. Setiap partikel sinar alfa bermuatan +2 dengan massa 4 sma, sedangkan partikel sinar beta sama dengan elektron, bermuatan –1 dan massa 1/8.400 sma (dianggap sama dengan nol). Adapun sinar gama adalah radiasi elektromagnetik, tidak bermassa, dan tidak bermuatan.
Pada tahun 1908, Hans Geiger dan Ernest Marsden yang bekerja di laboratorium Rutherford melakukan eksperimen dengan menembakkan sinar alfa (sinar bermuatan positif) pada pelat emas yang sangat tipis. Sebagian besar sinar alfa itu berjalan lurus tanpa gangguan, tetapi sebagian kecil dibelokkan dengan sudut yang cukup besar, bahkan ada juga yang dipantulkan kembali ke arah sumber sinar.
Dari hasil percobaan kedua asistennya itu, Ernest Rutherford menafsirkan sebagai berikut.
■ Sebagian besar partikel sinar alfa dapat menembus pelat karena melalui daerah hampa.
■ Partikel alfa yang mendekati inti atom dibelokkan karena mengalami gaya tolak inti.
■ Partikel alfa yang menuju inti atom dipantulkan karena inti bermuatan positif dan sangat massif
Gambar: Perobaan Rutherford menembakkan sinar alfa pada lempengan emas tipis
Beberapa tahun kemudian, yaitu tahun 1911, Ernest Rutherford mengungkapkan teori atom modern yang dikenal sebagai model atom Rutherford.
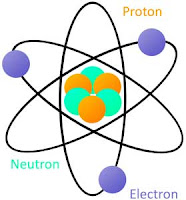
1. Atom tersusun dari:
● Inti atom yang bermuatan positif.
● Elektron-elektron yang bermuatan negatif dan mengelilingi inti.
2. Semua proton terkumpul dalam inti atom, dan menyebabkan inti atom bermuatan positif.
3. Sebagian besar volume atom merupakan ruang kosong. Hampir semua massa atom terpusat pada inti atom yang sangat kecil. Jari-jari atom sekitar 10–10 m, sedangkan jari-jari inti atom sekitar 10–15 m.
Gambar: Model atom Rutherford
3. Jumlah proton dalam inti sama dengan jumlah elektron yang mengelilingi inti, sedangkan atom bersifat netral.
Model Atom Rutherford Atom adalah bola berongga yang tersusun dari inti atom dan elektron yang mengelilinginya. Inti atom bermuatan positif dan massa atom terpusat pada inti atom.
|
Seperti halnya model atom pendahulunya, teori atom Rutherford memiliki kelemahan. Kelemahan utama terletak pada pergerakan elektron dalam mengelilingi inti atom. Menurut Hukum Fisika Klasik dari Maxwell, jika suatu partikel yang bermuatan listrik bergerak melingkar akan mengemisikan energinya dalam bentuk cahaya yang mengakibatkan percepatan partikel semakin berkurang dan akhirnya diam.
Dengan demikian, jika elektron yang bermuatan negatif bergerak melingkar (mengelilingi inti bermuatan positif) maka akan kehilangan energinya sehingga gerakan elektron akan berkurang, yang akhirnya akan jatuh ke inti. Gambar di bawah ini menunjukkan model atom Rutherford menurut teori Maxwell.
Gambar: Model atom Rutherford menurut teori Maxwell
Jadi, menurut Hukum Fisika Klasik, model atom Rutherford tidak stabil sebab elektron akan kehilangan energinya dan akan jatuh ke inti, pada akhirnya atom akan musnah. Akan tetapi, faktanya atom stabil.
Contoh Soal: Analisis Data Percobaan Rutherford
Fakta apakah yang dijadikan dasar kesimpulan oleh Rutherford bahwa inti atom berukuran sangat kecil?
Jawab:
Kesimpulan Rutherford didasarkan pada fakta bahwa dari sejumlah besar partikel alfa, hanya sebagian kecil yang dipantulkan. Hal ini menunjukkan bahwa ukuran inti atom sangat kecil.
Kelebihan Model Atom Rutherford
■ Dapat menerangkan fenomena penghamburan partikel alfa oleh selaput tipis emas.
■ Mengemukakan keberadaan inti atom yang bermuatan positif dan merupakan pusat massa atom.
■ Membuat hipotesa bahwa atom tersusun dari inti atom dan elektron yang mengelilingi inti dan satu sama lain terpisah oleh ruang hampa.
Kelemahan Model Atom Rutherford
■ Tidak dapat menjelaskan bahwa atom bersifat stabil. Teori atom Rutherford bertentangan dengan Hukum Fisika Maxwell. Jika partikel bermuatan negatif (elektron) bergerak mengelilingi partikel bermuatan berlawanan (inti atom bermuatan positif), maka akan mengalami percepatan dan memancarkan energi berupa gelombang elektromagnetik. Akibatnya energi elektron semakin berkurang. Jika demikian halnya maka lintasan elektron akan berupa spiral. Pada suatu saat elektron tidak mampu mengimbangi gaya tarik inti dan akhirnya elektron jatuh ke inti. Sehingga atom tidak stabil padahal kenyataannya atom stabil.
■ Tidak dapat menjelaskan bahwa spektrum atom hidrogen berupa spektrum garis (diskrit/diskontinu). Jika elektron berputar mengelilingi inti atom sambil memancarkan energi, maka lintasannya berbentuk spiral. Ini berarti spektrum gelombang elektromagnetik yang dipancarkan berupa spektrum pita (kontinu) padahal kenyataannya dengan spektrometer atom hidrogen menunjukkan spektrum garis.