Materi Reaksi Redoks (Reduksi Oksidasi) Lengkap + Contoh Soal dan Pembahasan
https://blogmipa-kimia.blogspot.com/2018/04/materi-reaksi-redoks-lengkap.html?m=0
Daftar Materi Kimia
Advertisement
Baca Juga:
Perubahan kimia yang terjadi di sekitar kita beragam jenisnya, seperti pembusukan, fermentasi, reaksi penggaraman atau penetralan, reaksi hidrolisis, reaksi pembakaran/oksidasi atau reaksi reduksi. Pada artikel ini akan dibahas reaksi redoks yaitu reaksi reduksi dan oksidasi, bilangan oksidasi, oksidator, reduktor, dan reaksi autoredoks.
Definisi Reaksi Oksidasi dan Reduksi
Di sekitar kita sering dijumpai peristiwa kimiawi seperti logam berkarat, pembuatan besi dari bijih besi, penyepuhan logam, terjadinya arus listrik pada aki atau baterai, buah masak, buah busuk, mercon meledak, kembang api dibakar, dan lain sebagainya.
Perkaratan pada logam, pembakaran, pembusukan oleh mikroba, fotosintesis pada tumbuhan, dan metabolisme di dalam tubuh merupakan sebagian contoh-contoh reaksi oksidasi dan reduksi.
#1 Konsep Redoks Berdasarkan Pengikatan dan Pelepasan Oksigen
Konsep reaksi oksidasi dan reduksi mengalami perkembangan dari masa ke masa sesuai cakupan konsep yang dijelaskan. Pada mulanya konsep reaksi oksidasi dan reduksi ditinjau dari penggabungan dan pelepasan oksigen.
■ Reaksi oksidasi didefinisikan sebagai reaksi penggabungan/pengikatan suatu zat dengan oksigen.
■ Sebaliknya reaksi pelepasan oksigen oleh suatu zat disebut reaksi reduksi.
Contoh reaksi oksidasi:
□ C(s) + O2(g) → CO2(g)
□ 4Fe(s) + 3O2(g) → 2Fe2O3(s)
□ Cu(s) + O2(g) → CuO(s)
□ S(s) + O2(g) → SO2(g)
□ SO2(g) + O2(g) → SO3(g)
Pada reaksi di atas C mengikat O2 membentuk CO2. Demikian juga Fe, Cu, S, dan SO2 berturut-turut menjadi Fe2O3, CuO, SO2, dan SO3 setelah mengikat oksigen. Jadi, C, Fe, Cu, S, dan SO2 telah mengalami reaksi oksidasi.
Contoh reaksi reduksi:
□ 2SO3(g) → 2SO2(g) + O2(g)
□ 2KClO3(s) → 2KCl(s) + 3O2(g)
□ 2KNO3(aq) → 2KNO2(aq) + O2(g)
Perhatikan reaksi di atas, SO3 melepaskan oksigen membentuk SO2, demikian juga KClO3 dan KNO3 masing-masing melepaskan oksigen menjadi KCl dan KNO2. Jadi, SO3, KClO3, dan KNO3 mengalami reaksi reduksi.
Pada reaksi termit menghasilkan besi cair yang sering digunakan untuk mengelas benda-benda dari besi, reaksinya adalah:
2Al(s) + Fe2O3(s) → 2Fe(l) + Al2O3(s)
|
Al mengikat oksigen membentuk Al2O3 berarti Al mengalami oksidasi. Fe2O3 melepaskan oksigen membentuk Fe. Jadi, Fe2O3 mengalami reduksi. Pada reaksi termit tersebut oksidasi dan reduksi terjadi bersamaan, reaksi seperti ini disebut reaksi redoks.
Contoh Soal dan Pembahasan:
Tentukan zat yang mengalami oksidasi, reduksi, sebagai oksidator, dan sebagai reduktor dari reaksi-reaksi berikut:
PbO(s) + H2(g) → Pb(s) + H2O(l)
Jawab:
PbO melepaskan oksigen, maka PbO mengalami reduksi sehingga PbO disebut oksidator. Sedangkan H2 mengikat oksigen, maka H2 mengalami oksidasi sehingga H2 disebut reduktor.
#2 Konsep Redoks Berdasarkan Pengikatan dan Pelepasan Elektron
Pada reaksi Na(s) + S(s) → Na2S(s) tidak melibatkan gas oksigen, maka konsep redoks berdasarkan pengikatan dan pelepasan oksigen tidak dapat digunakan. Konsep redoks berkembang, bukan lagi pengikatan dan pelepasan oksigen tetapi pengikatan dan pelepasan elektron.
■ Reaksi oksidasi adalah reaksi pelepasan elektron. Contohnya pada pembentukan ion Na+.
Na(s) → Na+(aq) + e–
|
■ Sebaliknya reaksi pengikatan elektron disebut reaksi reduksi. Contohnya pada pembentukan ion S2–.
S(s) + 2e– → S2–(aq)
|
■ Reaksi redoks adalah reaksi yang terjadi di mana reaksi oksidasi dan reduksi terjadi bersama-sama.
2Na(s) + S(s) → Na2S(s)
|
Reaksi di atas dapat ditulis menjadi 2 tahap yaitu:
Reaksi Oksidasi
|
:
|
2Na(s) → 2Na+(aq) + 2e–
|
Reaksi Reduksi
|
:
|
S(s) + 2e– → S2–(aq)
|
Reaksi Redoks
|
:
|
2Na(s) + S(s) → Na2S(s)
|
Pada reaksi di atas Na mengalami reaksi oksidasi dan menyebabkan S tereduksi. Zat seperti Na ini disebut reduktor. Sedangkan S disebut oksidator karena menyebabkan Na teroksidasi, dan dia sendiri mengalami reaksi reduksi.
Contoh Soal dan Pembahasan:
Tentukan setengah reaksi dari reaksi-reaksi berikut. Tunjukkan zat oksidator dan reduktornya.
Mg(s) + 2HCl(aq) → MgCl2(aq) + H2(g)
Jawab:
Reaksi di atas dapat juga ditulis sebagai berikut.
Mg(s) + 2H+(aq) → Mg2+(aq) + H2(g)
Reaksi ini dapat ditulis dalam dua tahap yang disebut setengah reaksi, yaitu sebagai berikut.
Setengah reaksi oksidasi
|
:
|
Mg(s) → Mg2+(aq) + 2e−
|
Setengah reaksi reduksi
|
:
|
2H+(aq) + 2e− → H2(g)
|
Reaksi keseluruhan
|
:
|
Mg(s) + 2H+(aq) → Mg2+(aq) + H2(g)
|
Dari reaksi di atas, yang merupakan zat oksidator adalah 2H+ atau HCl karena zat ini mengikat elektron. Sedangkan yang merupakan reduktor adalah Mg, karena zat ini melepas elektron.
#3 Konsep Redoks Berdasarkan Perubahan (Kenaikan dan Penurunan) Bilangan Oksidasi
Sebelum mempelajari konsep reaksi redoks berdasarkan kenaikan dan penurunan bilangan oksidasi ada baiknya kamu belajar tentang bilangan oksidasi terlebih dahulu. Bilangan oksidasi (bilok) adalah jumlah muatan yang dimiliki atom suatu unsur jika bergabung dengan atom unsur lain.
Aturan bilok:
□ Unsur bebas mempunyai bilok 0 (nol). Yang termasuk unsur bebas: unsur diatomik (H2, N2, O2, F2, Cl2, Br2, I2), unsur poliatomik (O3, P4, S8). Selain unsur tersebut adalah unsur monoatomik (Na, K, Mg, C, dan lain-lain).
Contoh:
● H dalam H2
● O dalam O2 dan O3
● F dalam F2
● Na dalam Na
□ Unsur H umumnya mempunyai bilok (+1), kecuali pada senyawa hidrida mempunyai bilok (–1). Senyawa hidrida adalah senyawa yang terbentuk jika logam bergabung dengan atom H (Contoh: NaH, KH, CaH2).
Contoh: H dalam H2O, NH3, HCl.
□ Unsur O umumnya mempunyai bilok (–2), kecuali:
● Pada senyawa peroksida contohnya: Na2O2, H2O2, BaO2 mempunyai bilok (–1).
● Senyawa F2O mempunyai bilok (+2), dan
● Senyawa superoksida (contohnya KO2) mempunyai bilok (–1/2). Contoh: O dalam H2O, Na2O, Fe2O3, MgO.
□ Unsur logam dalam senyawa umumnya mempunyai bilok positif.
Contoh:
● Golongan IA (Li, Na, K, Rb, dan Cs) mempunyai bilok (+1).
● Golongan IIA (Be, Mg, Ca, Sr, dan Ba) mempunyai bilok (+2).
● Al3+, Ag+, Zn2+, Pb2+, Pb3+, Fe2+, dan Fe3+.
□ Unsur nonlogam umumnya mempunyai bilok negatif.
Contoh:
● Golongan VIIA (F, Cl, Br, I) mempunyai bilok (–1).
● Golongan VIA (O, S, Se, Te) mempunyai bilok (–2).
□ Jumlah bilok unsur-unsur dalam ion sama dengan jumlah muatannya.
Contoh:
Bilok S dalam SO42–
Bilok O = –2
Jumlah bilok = (1 × bilok S + 4 × bilok O)
–2 = (1 × bilok S + 4 × (–2))
–2 = bilok S + (–8)
Bilok S = +6
□ Jumlah bilok unsur-unsur dalam senyawa sama dengan 0 (nol).
Contoh: H2S
Jumlah bilok = ((2 × bilok H) + (1 × bilok S))
0 = ((2 × (+1)) + (1 × bilok S))
0 = (+2) + bilok S
Bilok S = (–2)
Contoh Soal dan Pembahasan:
Tentukan bilangan oksidasi mangan pada
a. ion MnO4–
b. MnO2
Jawab:
a. Jumlah bilangan oksidasi unsur-unsur dalam suatu ion yang terdiri atas beberapa unsur sama dengan muatannya.
Bilangan oksidasi O = -2 maka
⇒ b.o Mn + (4 × b.o O) = -1
⇒ b.o Mn + (4 × -2) = -1
⇒ b.o Mn + (-8) = -1
⇒ b.o Mn = -1 + 8
⇒ b.o Mn = 7
Jadi, bilangan oksidasi Mn dalam ion MnO4– adalah 7.
b. Jumlah bilangan oksidasi unsur-unsur dalam senyawa sama dengan nol.
Bilangan oksidasi O = -2 maka
⇒ b.o Mn + (2 × b.o O) = 0
⇒ b.o Mn + (2 × -2) = 0
⇒ b.o Mn + (-4) = 0
⇒ b.o Mn = 0 + 4
⇒ b.o Mn = 4
Jadi, bilangan oksidasi Mn dalam MnO2 adalah 4.
Setelah menguasai bilok kita coba terapkan dalam reaksi redoks. Reaksi oksidasi adalah reaksi kenaikkan bilok. Sedangkan reaksi reduksi adalah reaksi penurunan bilok.
Contoh:
1. Zn(s) + 2HCl(aq) → ZnCl2(aq) + H2(g)
Bilok Zn (unsur bebas) = 0
Bilok Zn dalam ZnCl2 = +2
Berarti Zn mengalami kenaikkan bilok, maka Zn mengalami reaksi oksidasi.
Bilok H dalam HCl = +1
Bilok H dalam H2 (unsur bebas) = 0
Jadi, H mengalami penurunan bilok, maka H mengalami reaksi reduksi.
2. Reaksi pemakaian baterai: Zn + 2NH4Cl → ZnCl2 + 2NH3 + H2
Bilok Zn (unsur bebas) = 0
Bilok Zn pada ZnCl2 = +2
Berarti Zn mengalami kenaikkan bilok, maka Zn mengalami reaksi oksidasi.
Bilok H pada NH4Cl = +1
Bilok H pada H2 (unsur bebas = 0)
Berarti H mengalami penurunan bilok, maka H mengalami reaksi reduksi.
3. Reaksi pengolahan bijih besi
Fe2O3 + 3CO → 2Fe + 3CO2
Bilok Fe pada Fe2O3 = +3
Bilok Fe (unsur bebas) = 0
Berarti Fe mengalami penurunan bilok, maka Fe mengalami reaksi reduksi.
Bilok C pada CO = +2
Bilok C pada CO2 = +4
Berarti C mengalami kenaikkan bilok, maka C mengalami reaksi oksidasi.
4. Reaksi penyepuhan/pelapisan logam.
Cu + 2AgNO3 → Cu(NO3)2 + 2Ag
Bilok Cu (unsur bebas) = 0
Bilok Cu pada Cu(NO3)2 = +2
Berarti Cu mengalami kenaikkan bilok, maka Cu mengalami reaksi oksidasi.
Bilok Ag pada AgNO3 = +1
Bilok Ag (unsur bebas) = 0
Berarti Ag mengalami penurunan bilok, maka Ag mengalami reaksi reduksi.
Contoh Soal dan Pembahasan:
Jelaskan dengan menggunakan perubahan bilangan oksidasi, peristiwa reduksi dan oksidasi, serta tunjukkan zat oksidator dan zat reduktor pada reaksi berikut.
Zn(s) + H2SO4(aq) → ZnSO4(aq) + H2(g)
Penyelesaian:
□ Bilangan oksidasi Zn dalam Zn = 0.
□ Bilangan oksidasi H, S dan O dalam H2SO4:
Bilangan oksidasi H = +1
Bilangan oksidasi O = -2
Maka:
⇒ (2 × b.o H) + (b.o S) + (4 × b.o O) = 0
⇒ (2 × 1) + (b.o S) + (4 × -2) = 0
⇒ (2) + (b.o S) + (-8) = 0
⇒ b.o S + (-6) = 0
⇒ b.o S = 6
Jadi, bilangan oksidasi H, S dan O dalam H2SO4 adalah +1, -2, dan +6.
□ Bilangan oksidasi Zn dalam ZnSO4:
Reaksi penguraian ZnSO4 adalah sebagai berikut.
ZnSO4 → Zn2+ + SO42-
Karena bilangan oksidasi ion sama dengan jumlah muatannya, maka biloks Zn = +2.
□ Bilangan oksidasi H dalam H2 = 0.
Diagram persamaan reaksi Zn(s) + H2SO4(aq) → ZnSO4(aq) + H2(g) beserta bilangan oksidasinya adalah sebagai berikut.
Oksidator
|
:
|
H2SO4
|
Hasil oksidasi
|
:
|
ZnSO4
| |
Reduktor
|
:
|
Zn
|
Hasil reduksi
|
:
|
H2
|
Reaksi Autoredoks (Disproporsionasi)
Suatu reaksi kimia apabila terjadi kenaikan bilok (reaksi oksidasi) dan penurunan bilok (reaksi reduksi) secara bersama-sama, maka disebut reaksi redoks. Jika suatu zat mengalami reaksi oksidasi sekaligus reduksi, maka reaksi ini disebut autoredoks (disproporsionasi).
Contoh:
6NaOH(aq) + 3Cl2(g) → 5NaCl(aq) + NaClO3(aq) + 3H2O(l)
Bilok Cl dalam Cl2 (unsur bebas) = 0
Bilok Cl dalam NaCl = 1
Bilok Cl dalam NaClO3 = +5
Jadi, Cl mengalami kenaikkan bilok (reaksi oksidasi) dan penurunan bilok (reaksi reduksi) sekaligus. Maka reaksi di atas bisa dikatakan sebagai reaksi autoredoks.
Contoh Soal dan Pembahasan:
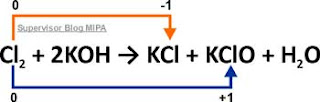
Apakah reaksi berikut termasuk reaksi autoredoks atau bukan? Jelaskan!
Cl2 + 2KOH → KCl + KClO + H2O
Jawab:
Pada reaksi ini, bilangan oksidasi atom Cl pada molekul Cl2 mengalami dua jenis perubahan bilangan oksidasi, yaitu kenaikan dan penurunan. Jadi, atom Cl tersebut mengalami reaksi reduksi sekaligus reaksi oksidasi atau disebut juga reaksi autoredoks.