Model/Teori Atom Niels Bohr: Pengertian, Gambar, Kekurangan dan Kelebihannya
https://blogmipa-kimia.blogspot.com/2018/04/model-atom-bohr.html?m=0
Daftar Materi Kimia
Advertisement
Baca Juga:
Dilihat dari kandungan energi elektron, ternyata model atom Rutherford mempunyai kelemahan. Ketika elektron-elektron mengelilingi inti atom, mereka mengalami percepatan terus-menerus, sehingga elektron harus membebaskan energi.
Lama kelamaan energi yang dimiliki oleh elektron makin berkurang dan elektron akan tertarik makin dekat ke arah inti, sehingga akhirnya jatuh ke dalam inti. Tetapi pada kenyataannya, seluruh elektron dalam atom tidak pernah jatuh ke inti. Jadi, model atom Rutherford harus disempurnakan.
Dua tahun berikutnya, yaitu pada tahun 1913, seorang ilmuwan dari Denmark yang bernama Niels Henrik David Bohr (1885- 1962) menyempurnakan model atom Rutherford. Model atom yang diajukan Bohr dikenal sebagai model atom Rutherford-Bohr, yang dapat diterangkan sebagai berikut.
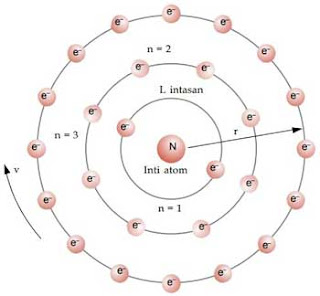
□ Elektron-elektron dalam atom hanya dapat melintasi lintasan-lintasan tertentu yang disebut kulit-kulit atau tingkat-tingkat energi, yaitu lintasan di mana elektron berada pada keadaan stationer, artinya tidak memancarkan energi.
□ Kedudukan elektron dalam kulit-kulit, tingkat-tingkat energi dapat disamakan dengan kedudukan seseorang yang berada pada anak-anak tangga. Seseorang hanya dapat berada pada anak tangga pertama, kedua, ketiga, dan seterusnya, tetapi ia tidak mungkin berada di antara anak tangga-anak tangga tersebut.
Model atom Bohr tersebut dapat dianalogkan seperti sebuah tata surya mini. Pada tata surya, planet-planet beredar mengelilingi matahari. Pada atom, elektron-elektron beredar mengelilingi atom, hanya bedanya pada sistem tata surya, setiap lintasan (orbit) hanya ditempati 1 planet, sedangkan pada atom setiap lintasan (kulit) dapat ditempati lebih dari 1 elektron.
Dalam model atom Bohr ini dikenal istilah konfigurasi elektron, yaitu susunan elektron pada masing-masing kulit. Data yang digunakan untuk menuliskan konfigurasi elektron adalah nomor atom suatu unsur, di mana nomor atom unsur menyatakan jumlah elektron dalam atom unsur tersebut.
Sedangkan elektron pada kulit terluar dikenal dengan sebutan elektron valensi. Susunan elektron valensi sangat menentukan sifat-sifat kimia suatu atom dan berperan penting dalam membentuk ikatan dengan atom lain.
Model atom Bohr menyempurnakan model atom Rutherford dalam hal kedudukan elektron di sekeliling inti atom.
|
Untuk menentukan konfigurasi elektron suatu unsur, ada beberapa patokan yang harus selalu diingat, yaitu:
□ Dimulai dari lintasan yang terdekat dengan inti, masing-masing lintasan disebut kulit ke-1 (kulit K), kulit ke-2 (kulit L), kulit ke-3 (kulit M), kulit ke-4 (kulit N), dan seterusnya.
□ Jumlah elektron maksimum (paling banyak) yang dapat menempati masing-masing kulit adalah:
2n2
|
Dengan n = nomor kulit
•Kulit K dapat menampung maksimal 2 elektron.
•Kulit L dapat menampung maksimal 8 elektron.
•Kulit M dapat menampung maksimal 18 elektron, dan seterusnya.
□ Kulit yang paling luar hanya boleh mengandung maksimal 8 elektron.
Poin Kunci:
|
Secara garis besar, model atom yang dikemukakan oleh Niels Bohr adalah sebagai berikut.
■ Elektron mengelilingi inti atom pada tingkat-tingkat energi tertentu yang disebut kulit elektron.
■ Elektron dapat pindah dari tingkat energi yang satu ke yang lain dengan melepaskan atau menyerap energi.
|
Contoh Soal: Menentukan Konfigurasi Elektron
Tulislah konfigurasi elektron dari unsur-unsur berikut.
a. Helium dengan nomor atom 2
b. Nitrogen dengan nomor atom 7
c. Oksigen dengan nomor atom 8
d. Kalsium dengan nomor atom 20
e. Bromin dengan nomor atom 35
Penyelesaian:
Unsur
|
Nomor
Atom
|
Konfigurasi Eletron pada Kulit
|
Elektron
Valensi
| |||
K
|
L
|
M
|
N
| |||
Helium
|
2
|
2
|
2
| |||
Nitrogen
|
7
|
2
|
5
|
5
| ||
Oksigen
|
8
|
2
|
6
|
6
| ||
Kalsium
|
20
|
2
|
8
|
8
|
2
|
2
|
Bromin
|
35
|
2
|
8
|
18
|
7
|
7
|
Pada model atom Bohr, lintasan stasioner elektron memiliki momentum sudut. Besarnya momentum sudut memenuhi syarat secara fisika, yang dirumuskan sebagai berikut.
mvr
|
=
|
nh
|
2π
|
Keterangan:
m = massa elektron
v = kecepatan elektron
r = jari-jari lintasan
h = tetapan Planck
n = bilangan kuantum Bohr, 1, 2, 3, 4, …
Postulat-postulat Bohr diperkuat dengan eksperimen-eksperimen yang dilakukannya, salah satunya penguraian sinar menjadi spektrum yang jelas. Pada tahun 1913, Niels Bohr mengemukakan teori struktur atom yang dapat menerangkan adanya spektrum garis serta kestabilan atom.
Ide eksperimen Bohr mirip dengan kejadian dalam kehidupan sehari-hari, yaitu terjadinya pelangi. Pelangi merupakan hasil uraian sinar matahari menjadi beberapa jenis cahaya tampak, di antaranya merah, jingga, kuning, ungu, dan lain-lain.
Kulit atau lintasan elektron dalam mengelilingi inti atom dilambangkan dengan n = 1, n = 2, n = 3, dan seterusnya. Lambang ini dinamakan bilangan kuantum. Model atom Bohr ditunjukkan pada Gambar di atas. Huruf K, L, M, dan seterusnya digunakan untuk menyatakan lintasan elektron dalam mengelilingi inti atom. Lintasan dengan n = 1 disebut kulit K, lintasan dengan n = 2 disebut kulit L, dan seterusnya.
Tabel Lambang Kulit Elektron Atom Bohr
Kulit ke-
|
1
|
2
|
3
|
4
|
Lambang
|
K
|
L
|
M
|
N
|
Energi Keadaan Dasar dan Tereksitasi
Suatu atom dikatakan memiliki energi terendah atau stabil jika elektronnya berada pada keadaan dasar. Keadaan dasar untuk atom hidrogen adalah jika elektronnya berada pada kulit, n = 1. Keadaan di mana n > 1 bagi atom hidrogen dinyatakan tidak stabil, keadaan ini disebut keadaan tereksitasi.
Jadi, apabila elektron dengan tingkat energi rendah pindah ke lintasan dengan tingkat energi lebih tinggi, maka elektron akan menyerap energi, peristiwa ini disebut eksitasi. Sebaliknya, apabila elektron pindah dari lintasan dengan tingkat energi lebih tinggi ke lintasan dengan tingkat energi lebih rendah, maka elektron akan memancarkan energi, peristiwa ini disebut deeksitasi.
Baik eksitasi maupun deeksitasi disebut peristiwa transisi elektron. Energi yang diserap atau dipancarkan pada peristiwa transisi elektron ini dinyatakan dengan persamaan sebagai berikut.
E = (∆n)hv
|
Keterangan:
E = tingkat energi
h = tetapan Planck = 6,6 × 10-34 J/s
v = frekuensi radiasi
n = kulit elektron
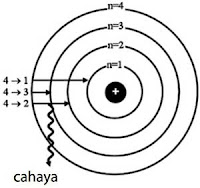
Pada keadaan tereksitasi, elektron yang kembali ke kulit semula disertai emisi energi sebesar (∆n)hv. Ketika elektron kembali ke kulit yang lebih rendah akan terbentuk suatu spektrum. Perhatikan Gambar berikut ini.
Keterangan gambar: Keadaan transisi elektron ketika elektron dari keadaan tereksitasi dan kembali ke keadaan dasar, disertai emisi energi dalam bentuk radiasi cahaya menghasilkan spektrum.
|
Gagasan Bohr tentang elektron mengelilingi inti atom dalam kulitkulit tertentu serupa dengan sistem tata surya kita, mudah dipahami. Oleh karena itu, model atom Bohr dapat diterima pada waktu itu.
Contoh Soal: Peralihan Tingkat Energi Elektron Menurut Model Atom Bohr
1. Gambarkan peralihan tingkat energi elektron atom hidrogen dari keadaan dasar ke tingkat energi n= 3. Berapakah energi yang diserap oleh atom hidrogen?
2. Gambarkan peralihan tingkat energi elektron atom hidrogen dari keadaan tereksitasi dengan n= 2 ke keadaan dasar. Berapakah energi yang dipancarkan oleh atom hidrogen?
Penyelesaian:
1. Atom hidrogen pada keadaan dasar memiliki bilangan kuantum, n = 1. Jika beralih ke tingkat energi n = 3 maka atom hidrogen menyerap energi sebesar 2hv.
2. Peralihan tingkat energi dari keadaan tereksitasi (n=2) ke keadaan dasar (n=1) akan diemisikan energi sebesar hv.
Kelebihan Model Atom Niels Bohr
□ Menjawab kelemahan dalam model atom Rutherford dengan mengaplikasikan teori kuantum.
□ Menerangkan dengan jelas garis spektrum pancaran (emisi) atau serapan (absorpsi) dari atom hidrogen.
□ Mampu membuktikan adanya lintasan elektron untuk atom hidrogen dengan jari-jari bola:
= 0,529 Angstrom
= 0,529 × 10–10 m
= 1 bohr
□ Bohr-sommerfeld mengembangkan orbit Bohr (bola) menjadi orbital yaitu fungsi gelombang elektron atau identitas elektron sebagai gelombang yang memiliki bentuk bola (l = 0, orbital s) atau 1 bola, (l = 1, orbital p) atau 2 balon terpilin, (l = 2, orbital d) atau 3 balon terpilin, (l = 3, orbital f).
Kelemahan Model Atom Niels Bohr
□ Hanya mampu menjelaskan spektrum atom hidrogen tetapi tidak mampu menjelaskan spektrum atom yang lebih kompleks (dengan jumlah elektron yang lebih banyak).
□ Orbit/kulit elektron mengelilingi inti atom bukan berbentuk lingkaran melainkan berbentuk elips.
□ Bohr menganggap elektron hanya sebagai partikel bukan sebagai partikel dan gelombang, sehingga kedudukan elektron dalam atom merupakan kebolehjadian.
□ Terjadi penyimpangan untuk atom yang lebih besar dari hidrogen.
□ Tidak dapat menerangkan efek Zaeman, yaitu spektrum atom yang lebih rumit apabila atom ditempatkan pada medan magnet.



Hhhhhhhhh
ReplyDelete