Konsep Reaksi Redoks Berdasarkan Biloks/Bilangan Oksidasi (Pertambahan atau Penurunan)
https://blogmipa-kimia.blogspot.com/2018/05/konsep-reaksi-redoks-berdasarkan-perubahan-biloks.html?m=0
Daftar Materi Kimia
Advertisement
Baca Juga:
Pada proses pelepasan elektron, muatan positif atom unsur akan bertambah. Sebaliknya, pada penangkapan elektron menyebabkan penurunan muatan positif atau penambahan muatan negatif atom unsur.
Bilangan oksidasi atau tingkat oksidasi adalah nilai muatan (dapat berharga positif atau negatif) dari atom dalam pembentukan suatu molekul atau ion. Bilangan oksidasi lazim disingkat biloks atau b.o. Beberapa atom hanya memiliki satu bilangan oksidasi, namun adapula atom yang memiliki lebih dari satu bilangan oksidasi.
Bilangan oksidasi merupakan suatu bilangan yang diberikan pada suatu unsur menurut aturan-aturan tertentu untuk menyatakan tingkat keteroksidasian atau tingkat ketereduksian.
Info Kimia
|
Banyak industri memanfaatkan reaksi redoks untuk menambah keuntungan usahanya. Industri makanan seperti nata de coco dan minyak kelapa memakai antioksidan (asam benzoat, vitamin C, E, dan sebagainya) agar makanan lebih awet.
Industri logam untuk meningkatkan mutu dan nilai tambah produknya melakukan penyepuhan untuk melindungi dari korosi. Industri tekstil memakai serbuk pemutih untuk menggelantang kain sehingga tampak lebih putih. Penggelantangan kain merupakan reaksi oksidasi.
|
Bilangan oksidasi suatu unsur pada suatu senyawa umumnya sama dengan jumlah elektron yang dilepas atau ditangkap atau dipasangkan oleh satu atom unsur itu pada senyawa tersebut. Unsur yang melepas elektron mempunyai bilangan oksidasi bertanda positif, sedangkan yang menangkap elektron bertanda negatif.
Pada senyawa kovalen, unsur yang lebih elektronegatif bertanda negatif, seolah-olah pasangan elektron milik bersama telah diambil oleh unsur tersebut.
Berdasarkan konsep serah terima elektron, reaksi redoks didefinisikan sebagai suatu reaksi yang berlangsung dengan mekanisme serah terima elektron. Oleh karena proses serah terima elektron ini menyebabkan perubahan muatan atom unsur-unsur yang terlibat, maka reaksi redoks dapat pula didefinisikan sebagai berikut.
Reaksi redoks adalah reaksi yang menyebabkan terjadinya perubahan biloks atom unsur-unsur yang terlibat.
|
Kawat tembaga berbentuk spiral dicelupkan ke dalam larutan AgNO3 yang bening, setelah beberapa lama larutan berubah menjadi bewarna biru muda dan kawat tembaga nampak makin tebal karena terlapis oleh suatu serbuk putih.
Fenome tersebut merupakan salah satu contoh reaksi redoks yang berlangsung secara spontan dan dapat dijelaskan dengan mekanisme serah terima elektron yang juga sangat berkaitan erat dengan konsep perubahan bilangan oksidasi (perhatikan persamaan reaksi berikut).
2AgNO3(aq) + Cu(s) → Cu(NO3)2(aq) + 2Ag(s)
Bilangan Oksidasi Unsur dalam Senyawa atau Ion
Untuk menentukan bilangan oksidasi (biloks) atom dalam suatu senyawa atau ion, kalian harus mengetahui lebih dahulu bilangan oksidasi ataom unsur lainnya yang bersifat umum. Adapun aturan-aturan untuk menetapkan bilangan oksidasi adalah sebagai berikut.
1. Unsur bebas mempunyai bilangan oksidasi = 0 (nol)
Contoh: bilangan oksidasi H, N, dan Fe berturut-turut dalam H2, N2, dan Fe adalah 0.
2. Fluorin, unsur yang paling elektronegatif dan membutuhkan tambahan 1 elektron, mempunyai bilangan oksidasi -1 pada semua senyawanya.
3. Bilangan oksidasi unsur logam selalu bertanda positif. Bilangan oksidasi beberapa unsur logam adalah sebagai berikut.
□ Golongan IA (logam alkali) : Li, Na, K, Rb, Cs = +1
□ Golongan IIA (alkali tanah) : Be, Mg, Ca, Sr, Ba = +2
Al
|
=
|
+3
|
Fe
|
=
|
+2 dan +3
| |
Zn
|
=
|
+2
|
Hg
|
=
|
+1 dan +2
| |
Ag
|
=
|
+1
|
Cu
|
=
|
+1 dan +2
| |
Sn
|
=
|
+2 dan +4
|
Au
|
=
|
+1 dan +3
| |
Pb
|
=
|
+2 dan +4
|
Pt
|
=
|
+2 dan +4
|
4. Bilangan oksidasi suatu unsur dalam suatu ion tunggal sama dengan muatannya.
Contoh: bilangan oksidasi Fe dalam ion Fe3+ = +3, bilangan oksidasi S dalam ion S2- = -2.
5. Bilangan oksidasi H umumnya = +1, kecuali dalam senyawanya dengan logam maka bilangan oksidasi H = -1.
Contoh: bilangan oksidasi H dalam HCl, H2O, NH3 = +1, bilangan oksidasi H dalam NaH, BaH2 = -1.
6. Bilangan oksidasi O umumnya = -2
Contoh: bilangan oksidasi O dalam H2O, MgO = -2
Kecuali:
□ Dalam F2O, bilangan oksidasi O = +2
□ Dalam peroksida, seperti H2O2, bilangan oksidasi O = -1
□ Dalam superoksida, seperti KO2, bilangan oksidasi O = -1/2
7. Jumlah bilangan oksidasi unsur-unsur dalam suatu senyawa = 0.
Contoh: dalam H2SO4 : (2 × b.o H) + (b.o S) + (4 × b.o O) = 0
8. Jumlah bilangan oksidasi unsur-unsur dalam suatu ion poliatom = muatannya.
Contoh: dalam S2O32- : (2 × b.o S) + (3 × b.o O) = -2.
Kesimpulan: Konsep Redoks Berdasarkan Perubahan Biloks
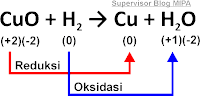
Pada suatu reaksi, perubahan bilangan oksidasi unsur-unsurnya menunjukkan terjadinya reaksi oksidasi dan reduksi. Untuk memahaminya perhatikan reaksi berikut.
Oksidator
|
:
|
CuO
|
Hasil oksidasi
|
:
|
H2O
| |
Reduktor
|
:
|
H2
|
Hasil reduksi
|
:
|
Cu
|
Bilangan oksidasi Cu pada CuO = +2 dan pada Cu = 0. Bilangan oksidasi Cu mengalami penurunan dari +2 menjadi 0. Bilangan oksidasi H pada H2 = 0 dan pada H2O = +1. Bilangan oksidasi H mengalami kenaikan dari 0 menjadi +1.
Pada reaksi tersebut dinyatakan CuO mengalami reduksi dan H2 mengalami oksidasi. Dengan demikian berdasarkan perubahan bilangan oksidasinya, oksidasi adalah peristiwa kenaikan bilangan oksidasi dan reduksi adalah peristiwa penurunan bilangan oksidasi. Pada reaksi ini CuO bertindak sebagai oksidator. H2 bertindak sebagai reduktor.
Penggunaan bilangan oksidasi pada reaksi redoks lainnya dapat dilihat pada contoh berikut ini.
Contoh 1:
Oksidator
|
:
|
O2
|
Hasil oksidasi
|
:
|
H2O atau H+
| |
Reduktor
|
:
|
H2
|
Hasil reduksi
|
:
|
H2O atau O2-
|
Contoh 2:
Oksidator
|
:
|
HNO3
|
Hasil oksidasi
|
:
|
Cu(NO3)2 atau Cu2+
| |
Reduktor
|
:
|
Cu
|
Hasil reduksi
|
:
|
NO2
|
Dari penjelasan di atas, maka dapat disimpulkan sebagai berikut.
□ Oksidasi adalah peristiwa kenaikan bilangan oksidasi suatu unsur.
□ Reduksi adalah peristiwa penurunan bilangan oksidasi suatu unsur.
□ Oksidator mengalami penurunan bilangan oksidasi.
□ Reduktor mengalami kenaikan bilangan oksida
|
Contoh Soal dan Pembahasan
Jelaskan dengan menggunakan perubahan bilangan oksidasi, peristiwa reduksi dan oksidasi, serta tunjukkan zat oksidator dan zat reduktor pada reaksi berikut.
1. Ca(s) + 2HCl(aq) → CaCl2(aq) + H2(g)
Penyelesaian:
□ Bilangan oksidasi Ca dalam Ca = 0
□ Bilangan oksidasi H dan Cl dalam HCl:
Reaksi penguraian HCl adalah sebagai berikut.
HCl → H+ + Cl-
Jadi, muatan ion dalam HCl adalah:
H+ = 1+ dan Cl− = −1
Karena bilangan oksidasi ion sama dengan jumlah muatannya, maka biloks H = +1 dan biloks Cl = −1.
□ Bilangan oksidasi Ca dan Cl dalam CaCl2:
Reaksi penguraian CaCl2 adalah sebagai berikut.
CaCl2 → Ca2+ + 2Cl-
Jadi, muatan ion dalam CaCl2 adalah:
Ca2+ = 2+ dan Cl− = −1
Karena bilangan oksidasi ion sama dengan jumlah muatannya, maka biloks Ca = +2 dan biloks Cl = −1.
□ Bilangan oksidasi H dalam H2 = 0.
Diagram persamaan reaksi Ca(s) + 2HCl(aq) → CaCl2(aq) + H2(g) beserta bilangan oksidasinya adalah sebagai berikut.
Oksidator
|
:
|
HCl
|
Hasil oksidasi
|
:
|
CaCl2
| |
Reduktor
|
:
|
Ca
|
Hasil reduksi
|
:
|
H2
|
2. Cl2(g) + 2NaBr(aq) → 2NaCl(aq) + Br2(g)
Penyelesaian:
□ Bilangan oksidasi Cl dalam Cl2 = 0.
□ Bilangan oksidasi Na dan Br dalam NaBr:
Reaksi penguraian NaBr adalah sebagai berikut.
NaBr → Na+ + Br-
Jadi, muatan ion dalam NaBr adalah:
Na+ = 1+ dan Br− = −1
Karena bilangan oksidasi ion sama dengan jumlah muatannya, maka biloks Na = +1 dan biloks Br = −1.
□ Bilangan oksidasi Na dan Cl dalam NaCl:
Reaksi penguraian NaCl adalah sebagai berikut.
NaCl → Na+ + Cl-
Jadi, muatan ion dalam NaCl adalah:
Na+ = 1+ dan Cl− = −1
Karena bilangan oksidasi ion sama dengan jumlah muatannya, maka biloks Na = +1 dan biloks Cl = −1.
□ Bilangan oksidasi Br dalam Br2 = 0.
Diagram persamaan reaksi Cl2(g) + 2NaBr(aq) → 2NaCl(aq) + Br2(g) beserta bilangan oksidasinya adalah sebagai berikut.
Oksidator
|
:
|
Cl2
|
Hasil oksidasi
|
:
|
Br2
| |
Reduktor
|
:
|
NaBr
|
Hasil reduksi
|
:
|
NaCl
|
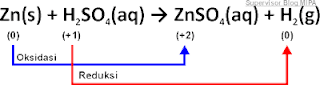
3. Zn(s) + H2SO4(aq) → ZnSO4(aq) + H2(g)
Penyelesaian:
□ Bilangan oksidasi Zn dalam Zn = 0.
□ Bilangan oksidasi H, S dan O dalam H2SO4:
Bilangan oksidasi H = +1
Bilangan oksidasi O = -2
Maka:
⇒ (2 × b.o H) + (b.o S) + (4 × b.o O) = 0
⇒ (2 × 1) + (b.o S) + (4 × -2) = 0
⇒ (2) + (b.o S) + (-8) = 0
⇒ b.o S + (-6) = 0
⇒ b.o S = 6
Jadi, bilangan oksidasi H, S dan O dalam H2SO4 adalah +1, -2, dan +6.
□ Bilangan oksidasi Zn dalam ZnSO4:
Reaksi penguraian ZnSO4 adalah sebagai berikut.
ZnSO4 → Zn2+ + SO42-
Karena bilangan oksidasi ion sama dengan jumlah muatannya, maka biloks Zn = +2.
□ Bilangan oksidasi H dalam H2 = 0.
Diagram persamaan reaksi Zn(s) + H2SO4(aq) → ZnSO4(aq) + H2(g) beserta bilangan oksidasinya adalah sebagai berikut.
Oksidator
|
:
|
H2SO4
|
Hasil oksidasi
|
:
|
ZnSO4
| |
Reduktor
|
:
|
Zn
|
Hasil reduksi
|
:
|
H2
|
4. Fe(s) + Cu2+(aq) → Fe2+ + Cu(s)
Penyelesaian:
□ Bilangan oksidasi Fe = 0.
□ Bilangan Cu2+ = +2.
□ Bilangan Fe2+ = +2.
□ Bilangan oksidasi Cu = 0.
Diagram persamaan reaksi Fe(s) + Cu2+(aq) → Fe2+ + Cu(s) beserta bilangan oksidasinya adalah sebagai berikut.
Oksidator
|
:
|
Cu2+
|
Hasil oksidasi
|
:
|
Fe2+
| |
Reduktor
|
:
|
Fe
|
Hasil reduksi
|
:
|
Cu
|





ijin copas ya contoh soalnya
ReplyDelete