Model/Teori Atom Thomson: Pengertian, Gambar, Kekurangan dan Kelebihannya
https://blogmipa-kimia.blogspot.com/2018/04/model-atom-thomson.html
Daftar Materi Kimia
Advertisement
Baca Juga:
Konsep atom pertama kali dikemukakan oleh Democritus. Atom berasal dari kata atomos (dalam bahasa Yunani a = tidak, tomos = dibagi), jadi atom merupakan partikel yang sudah tidak dapat dibagi lagi. Menurut Dalton konsep atom Democritus ini tidak bertentangan dengan Hukum Kekekalan Massa dan Hukum Kekekalan Energi, sehingga Dalton membuat teori tentang atom yang salah satunya adalah materi tersusun atas partikel-partikel terkecil yang tidak dapat dibagi lagi.
Tetapi konsep atom Dalton belum memuaskan para ilmuwan pada masa itu. Ditemukannya elektron, proton, neutron, dan radioaktivitas menyebabkan timbulnya teori baru tentang atom. Mulai dari teori atom Thomson, Rutherford, Bohr, dan Mekanika Kuantum. Nah, pada kesempatan kali ini kita akan mempelajari model atom yang dikemukakan oleh Thomson. Berikut penjelasan lengkapnya.
Model Atom Thomson
Setelah tahun 1897 Joseph John Thomson berhasil membuktikan dengan tabung sinar katode bahwa sinar katode adalah berkas partikel yang bermuatan negatif (berkas elektron) yang ada pada setiap materi maka tahun 1898 J. J.Thomson membuat suatu teori atom.
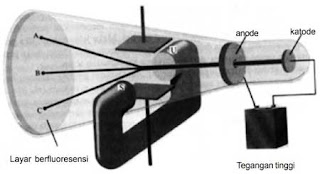
Keterangan Gambar:
Tabung sinar katode dengan medan listrik yang tegak lurus dengan arah sinar katode dan medan magnetik luar. Lambang U dan S menandakan kutub utara dan selatan magnet. Sinar katode akan menumbuk ujung tabung di A dengan adanya medan listrik, di C dengan adanya medan listrik, dan di B di mana tidak ada medan luar atau ketika pengaruh medan listrik dan medan magnetik saling menghilangkan.
Thomson adalah seorang fisikawan berkebangsaan Inggris, dia memperlihatkan bahwa elektron merupakan partikel subatomik. Dari penemuannya ini, J. J. Thomson mengemukakan dugaan (hipotesis) sebagai berikut:
"karena elektron bermuatan negatif, sedangkan atom bermuatan listrik netral maka haruslah ada muatan listrik positif yang mengimbangi muatan elektron dalam atom".
|
Maka ia mengusulkan suatu model atom yang dikenal dengan model atom roti kismis sebagai berikut.
1. Atom berbentuk bola pejal bermuatan positif yang homogen (diibaratkan sebagai roti).
2. Elektron bermuatan negatif tersebar di dalamnya (seperti kismis yang tersebar di dalam roti).
Jika model atom Thomson ini digambarkan dalam bentuk tiga dimensi akan mirip kue onde, bijih wijen menyatakan elektron dan onde menyatakan bentuk atom. Jika model atom Thomson dibelah dua maka elektron-elektron di dalam atom akan tampak seperti bijih jambu batu yang tersebar merata di dalam jambu.
Karena muatan positif dan negatif bercampur jadi satu dengan jumlah yang sama, maka secara keseluruhan atom menurut Thompson bersifat netral. Model atom Thomson tidak bertahan lama. Hal ini disebabkan karena model atom Thomson tidak menjelaskan adanya inti atom.
Kelebihan Model Atom Thomson
■ Membuktikan adanya partikel lain yang bermuatan negatif dalam atom.
■ Dapat menerangkan adanya partikel yang lebih kecil dari atom yang disebut partikel subatomik.
■ Dapat memastikan bahwa atom tersusun dari partikel yang bermuatan positif dan negatif untuk membentuk atom netral.
■ Dapat membuktikan bahwa elektron terdapat dalam semua unsur.
■ Dapat menerangkan sifat listrik atom.
Kelemahan Model Atom Thomson
■ Tidak dapat menerangkan fenomena penghamburan partikel alfa oleh selaput tipis emas yang dikemukakan oleh Rutherford.
■ Belum dapat menerangkan bagaimana susunan muatan positif dan jumlah elektron dalam bola.