Cara Menentukan Larutan Elektrolit Kuat, Lemah dan Nonelektrolit
https://blogmipa-kimia.blogspot.com/2018/02/menentukan-larutan-elektrolit-kuat-lemah-dan-nonelektrolit.html?m=0
Daftar Materi Kimia
Advertisement
Baca Juga:
Dalam kehidupan sehari-hari, kita sering mendengar kata larutan. Peran larutan sangat penting di antaranya adalah cairan tubuh kita yang mengandung komponen larutan dari berbagai zat kimia, mineral yang terdapat di kulit bumi kebanyakan ditemukan dalam bentuk larutan, serta reaksi kimia di laboratorium dan industri kebanyakan berlangsung dalam bentuk larutan.
Larutan adalah campuran homogen dua zat atau lebih yang saling melarutkan dan masing-masing zat penyusunnya tidak dapat dibedakan secara fisik. Larutan terdiri atas dua komponen, yaitu komponen zat terlarut dan pelarut.
■ Komponen dengan jumlah yang sedikit biasanya dinamakan zat terlarut.
■ Pelarut adalah komponen yang jumlahnya lebih banyak atau yang strukturnya tidak berubah.
Berdasarkan kemampuan menghantarkan arus listrik, larutan dibedakan menjadi dua jenis yaitu larutan elektrolit dan larutan nonelektrolit. Nah berdasarkan kekuatan daya hantar listriknya, larutan elektrolit dibedakan menjadi dua macam yaitu larutan elektrolit kuat dan elektrolit lemah. Lalu tahukah kalian bagaimana cara menentukan suatu larutan bersifat elektrolit kuat, lemah atau nonelektrolit? Berikut penjelasannya.
Menentukan Larutan Elektrolit dan Nonelektrolit
Dalam artikel tentang sifat unsur logam, nonlogam dan metaloid telah dibahas mengenai sifat-sifat logam. Salah satunya adalah logam merupakan konduktor listrik yang baik (ingat teori lautan elektron pada logam). Apakah larutan dapat menghantarkan listrik? jika ya, bagaimana prosesnya? Apakah sama dengan teori lautan elektron?
Logam dapat menghantarkan listrik sebab adanya elektron yang dapat bergerak bebas. Aliran listrik sendiri adalah aliran elektron yang bergerak dari potensial tinggi ke potensial rendah. Air murni tersusun atas molekul-molekul H2O. Adakah elektron bebas dalam molekul H2O? Molekul H2O bersifat netral, tidak memiliki elektron bebas. Akibatnya, kita dapat menduga bahwa air murni tidak memiliki potensi untuk menghantarkan listrik.
Bagaimana jika dalam air terdapat zat terlarut? Bergantung pada sifat zat terlarut, ada larutan yang dapat menghantarkan listrik ada juga yang tidak dapat menghantarkan listrik. Larutan yang dapat menghantarkan arus listrik disebut larutan elektrolit, sedangkan larutan yang tidak dapat menghantarkan arus listrik disebut larutan nonelektrolit.
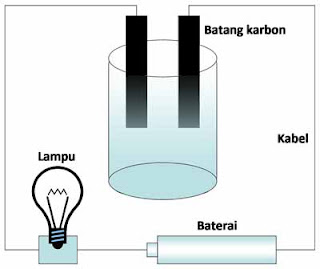
Untuk mengetahui daya hantar listrik dari larutan, kalian dapat mempelajari hasil percobaan berikut. Terdapat beberapa macam larutan dengan kadar tertentu, yang dilewatkan aliran listrik ke dalamnya. Indikator yang digunakan adalah lampu listrik kecil seperti pada gambar di bawah ini.
No.
|
Larutan
|
1.
|
Garam dapur 15%
|
2.
|
Alkohol 10% volume
|
3.
|
Gula pasir 5% berat
|
4.
|
Cuka 10% volume
|
5.
|
Asam klorida 10% volume
|
Berdasarkan data hasil pengamatan, diketahui bahwa garam dapur (NaCl) dan asam klorida (HCl) dapat menyala dengan terang. Asam asetat atau cuka (CH3COOH) menyala, tetapi redup. Adapun alkohol (C2H5OH) dan gula pasir (C12H22O11) tidak menyala, mengapa? Pada materi Ikatan Kimia, kalian sudah belajar tentang senyawa ion dan senyawa kovalen. Bagaimana sifat listrik dari kedua senyawa itu?
Senyawa ion terbentuk melalui transfer elektron menghasilkan kation dan anion. Kedua spesi kimia ini memiliki muatan listrik positif dan negatif. Contohnya adalah garam dapur atau NaCl. Jika garam dapur dilarutkan ke dalam air, akan terurai membentuk ion-ionnya sehingga dalam larutan NaCl terdapat spesi yang bermuatan listrik, yakni Na+ dan Cl–. Reaksi penguraian tersebut adalah sebagai berikut.
NaCl(aq) → Na+(aq) + Cl–(aq)
Pada saat elektrode dihubungkan dengan sumber arus, ion-ion Na+ dan Cl– akan bergerak menuju elektrode-elektrode yang berlawanan muatan dengan membawa muatan listrik. Jadi, listrik dapat mengalir dari satu elektrode ke elektrode lain melalui ion-ion dalam larutan.
Alkohol dan gula pasir tergolong senyawa kovalen. Apa yang terjadi jika kedua senyawa ini dilarutkan dalam air? Oleh karena pembentukan ikatan kovalen tidak melalui transfer elektron maka senyawa kovalen tidak terionisasi (dengan beberapa pengecualian), melainkan terurai secara molekuler. Akibatnya, di dalam larutan tidak ada spesi yang dapat menghantarkan arus litrik.
C2H5OH(l) → C2H5OH(aq)
C12H22O11(s) → C12H22O11(aq)
Contoh Soal: Menentukan Larutan Elektrolit dan Nonelektrolit
Perhatikan data hasil percobaan yang ditabulasikan ke dalam tabel berikut.
Larutan
|
Nyala Lampu
|
Gejala di Elektroda
|
A
|
Terang
|
Terjadi gelembung
|
B
|
Terang
|
Terjadi gelembung
|
C
|
Redup
|
Sedikit gelembung
|
D
|
Tidak
|
Tidak ada gelembung
|
Manakah yang tergolong larutan elektrolit dan nonelektrolit?
Jawab:
Larutan elektrolit dapat menghantarkan arus listrik yang ditandai dengan lampu yang menyala dan di elektrode terbentuk gelembung gas akibat peristiwa elektrolisis. Jadi, larutan A, B, dan C, tergolong larutan elektrolit. Sedangkan larutan nonelektrolit tidak dapat menghantarkan arus listrik yang ditandai dengan lampu tidak menyala dan tidak terjadi gelembung gas. Jadi larutan D tergolong larutan nonelektrolit.
Menentukan Larutan Elektrolit Kuat dan Elektrolit Lemah
Pada percobaan yang lain, HCl dan CH3COOH terbentuk melalui ikatan kovalen, tetapi dapat menghantarkan arus listrik, mengapa? Harus diingat bahwa semua asam terbentuk melalui ikatan kovalen, tetapi di dalam pelarut air, asam-asam akan terurai menjadi ion H+ dan ion negatif sisa asam, dalam kasus ini adalah ion Cl– dan ion CH3COO–.
Oleh karena semua asam terionisasi di dalam pelarut air maka dapat diduga bahwa larutan asam dapat menghantarkan arus listrik melalui proses yang serupa dengan senyawa-senyawa ion. Mengapa asam-asam yang berikatan kovalen dapat terionisasi dalam pelarut air? Mengapa HCl dapat menyalakan lampu dengan terang, sedangkan CH3COOH kurang terang?
Atom hidrogen hanya memiliki satu elektron dan berperan sebagai elektron valensi. Jika elektron valensi lepas maka yang tersisa hanya inti atom hidrogen yang bermuatan positif. Gugus sisa asam memiliki kekuatan untuk menarik pasangan elektron pada ikatan yang digunakan bersama dengan atom hidrogen. Kekuatan tarikan bergantung pada sifat dan struktur gugus sisa asam.
Jika asam dilarutkan dalam air, gugus sisa asam akan menarik pasangan elektron ikatan sehingga terurai membentuk ion sisa asam yang bermuatan negatif (kelebihan elektron) dan atom hidrogen yang sudah kehilangan elektron valensinya (membentuk ion H+). Oleh karena daya tarik gugus sisa asam terhadap pasangan elektron ikatan beragam maka pembentukan ion H+ dan ion sisa asam dalam pelarut air tidak sama.
Asam-asam kuat seperti HCl, HNO3, dan H2SO4, gugus sisa asamnya memiliki daya tarik relatif kuat terhadap pasangan elektron ikatan sehingga hampir semua molekul asam dalam air terionisasi. Dapat dikatakan bahwa asam-asam tersebut terionisasi sempurna.
HCl(aq) → H+(aq) + Cl–(aq)
Asam-asam lemah seperti CH3COOH, H2S, HCN, dan H2SO3 , gugus sisa asamnya memiliki daya tarik kurang kuat sehingga tidak semua molekul-molekul asam ini dalam air terionisasi, tetapi hanya sebagian kecil. Sisanya tetap dalam bentuk molekulnya.
CH3COOH(aq) ↔ H+(aq)+CH3COO–(aq)
Tanda panah dua arah menunjukkan hanya sebagian kecil dari asam asetat terurai menjadi ion-ionnya. Umumnya tetap sebagai molekul (perhatikan Gambar 6.8).
Contoh Soal: Menentukan Larutan Elektrolit Kuat dan Lemah
Mengapa larutan NH4Cl 5% di dalam air dapat menghantarkan arus listrik dengan baik (lampu menyala terang), sedangkan larutan NH3 10% menyala redup? Jelaskan.
Jawab:
NH4Cl tergolong senyawa ion. Jika dilarutkan dalam air akan terionisasi membentuk ion NH4+ dan ion Cl–.
Persamaan ionisasinya:
NH4Cl(aq) → NH4+(aq) + Cl–(aq)
Oleh karena daya hantar listrik NH4Cl baik, berarti ionisasinya sempurna.
NH3 tergolong senyawa kovalen. Jika dilarutkan dalam air, sebagian kecil NH3 dapat bereaksi dengan molekul-molekul air membentuk spesi bermuatan listrik.
Persamaan reaksinya:
NH3(aq) + H2O(l) ↔ NH4+(aq) + OH–(aq)
Oleh karena hanya sebagian kecil dari molekul NH3 yang bereaksi dengan air maka hanya ada sedikit ion-ion NH4+ dan OH– dalam larutan NH3 yang dapat menghantarkan arus listrik. Dengan demikian, larutan NH3 tergolong larutan elektrolit lemah.
Kesimpulan
Dari penjelasan di atas, maka beberapa karakteristik dari suatu larutan yang perlu diketahui untuk menentukan apakah larutan tersebut bersifat elektrolit kuat, elektrolit lemah atau nonelektrolit yaitu sebagai berikut.
Elektrolit Kuat
|
Elektrolit Lemah
|
Nonelektrolit
| |
Jenis ikatan kimia
zat terlarut
|
Ionik atau kovalen polar
|
Kovalen polar
|
Kovalen nonpolar
|
Tipe Ionisasi di
dalam pelarut
|
Ionisasi sempurna
|
Ionisasi sebagian
|
Tidak terionisasi
|

waww keren sangat mbak ! Sangat Membantu saya dalam mengerjakan soal soal yang di berikan oleh guru saya ! Semangat terus mbak Buat ngeUPDATE ! Saya akan selalu menunggu mbak ! Hingga KE tahap pelaminan !!!!!!!
ReplyDeleteThank You For Solving all my Problem !!!!
Thank You Very Much <3
Love You Mbakkk!!!
Good Bye
Tidur Yang Nyenyak Ya Mbak !!
Jangan Lupa Doain saya Yang Mbak !!
Thanks 😘
ReplyDeleteYou are welcome.
DeleteVerry Thanksss
ReplyDeleteSangat Membantu Saya Untuk Menghadapi Pts Tahun Ini!