12 Perbedaan Sifat Larutan Elektrolit dan Nonelektrolit
https://blogmipa-kimia.blogspot.com/2018/01/perbedaan-larutan-elektrolit-dan-nonelektrolit.html?m=0
Daftar Materi Kimia
Advertisement
Baca Juga:
Jika kalian berangkat ke sekolah, kalian biasanya menggunakan alat transportasi, seperti mobil, bus, atau sepeda motor. Apakah kalian tahu kendaraan yang kalian gunakan memakai larutan kimia untuk menghasilkan tenaga listrik? suatu kendaraan bermotor biasanya menggunakan aki (accu) untuk menghidupkan mesin. Alat ini dapat menghantarkan listrik sehingga pada malam hari kaian juga dapat menggunakan kendaraan karena penerangan lampu yang dihasilkan aki.
Pernahkah terpikirkan oleh kalian mengapa air dapat mengalirkan arus listrik? Suatu larutan dapat menghantarkan listrik disebut dengan larutan elektrolit sedangkan larutan yang tidak dapat menghantarkan arus listrik disebut larutan nonelektrolit. Nah, pada kesempatan kali ini kita akan belajar mengenai perbedaan sifat antara larutan elektrolit dan larutan nonelektrolit. Untuk itu silahkan kalian simak penjelasan berikut ini.
Sifat Hantar Listrik
Mobil, bus, dan sepeda motor merupakan alat transportasi yang banyak digunakan. Salah satu bagian yang berperan penting dalam kendaraan adalah aki. Alat yang berfungsi untuk menghidupkan mesin ini mengandung larutan asam sulfat yang merupakan suatu larutan elektrolit. Larutan elektrolit dapat menghantarkan arus listrik. Sifat inilah yang menyebabkan larutan asam sulfat dapat menghidupkan mesin kendaraan.
Selain asam sulfat, larutan-larutan apa sajakah yang dapat menghantarkan arus listrik? Mengapa larutan elektrolit dapat menghantarkan arus listrik? Adakah hubungan antara ikatan kimia dan larutan elektrolit? Untuk mengungkap rahasia tersebut, lakukanlah penyelidikan berikut.
Percobaan: Sifat Larutan Elektrolit
Tujuan:
Menyelidiki sifat-sifat larutan elektrolit
Alat dan Bahan:
1.
|
Batu baterai 1,5 volt 2 buah
|
8.
|
Dudukan baterai
| |
2.
|
Kabel tembaga 1 meter
|
9.
|
Dudukan lampu
| |
3.
|
Lampu 1 watt
|
10.
|
Gelas kimia 7 buah
| |
4.
|
Larutan garam daput 1 M
|
11.
|
Larutan alkohol 5%
| |
5.
|
Larutan asam asetat 1 M
|
12.
|
Larutan amonia 1 M
| |
6.
|
Larutan asam klorida 1 M
|
13.
|
Larutan natrium hidroksida 1 M
| |
7.
|
Larutan gula 5%
|
14.
|
Batang karbon sebagai elektroda
|
Sebelum melakukan percobaan, carilah informasi mengenai bahan-bahan kimia yang akan kalian gunakan meliputi sifat, penggunaan, dan penanganannya.
Langkah Kerja:
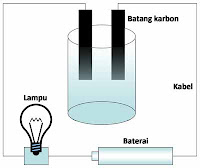
1. Rangkailah alat seperti pada gambar di bawah ini.
2. Tuangkan larutan garam dapur ke dalam gelas kimia hingga volume gelas kimia berisi ¾-nya.
3. Sentuhkan elektroda-elektroda karbon ke dalam larutan dalam gelas kimia.
4. Amati yang terjadi pada lampu dan larutan.
5. Lakukan langkah nomor 2-4 untuk 6 jenis larutan lainnya.
6. Catat hasil pengamatan di dalam buku praktikum kalian seperti contoh tabel berikut ini.
Larutan Uji
|
Hasil Pengamatan
| ||||
Nyala Lampu
|
Gelembung
| ||||
Terang
|
Redup
|
Tidak Menyala
|
Ada
|
Tidak Ada
| |
Larutan garam daput 1 M
| |||||
Larutan asam asetat 1 M
| |||||
Larutan asam klorida 1 M
| |||||
Larutan gula 5%
| |||||
Larutan alkohol 5%
| |||||
Larutan amonia 1 M
| |||||
Larutan natrium hidroksida 1 M
| |||||
Jawablah pertanyaan berikut untuk menyimpulkan fakta
1. Larutan mana sajakah yang dapat menghantarkan arus listrik?
2. Larutan mana sajakah yang tidak dapat menghantarkan arus listrik?
3. Apakah perbedaan sifat antara larutan yang dapat menghantarkan arus listrik dan yang tidak dapat menghantarkan arus listrik?
4. Mengapa larutan elektrolit dapat menghantarkan arus listrik?
5. Gambarkanlah struktur ikatan kimia dari senyawa-senyawa yang terlarut dalam larutan-larutan yang dapat menghantarkan arus listrik.
Karakteristik Larutan Elektrolit dan Nonelektrolit
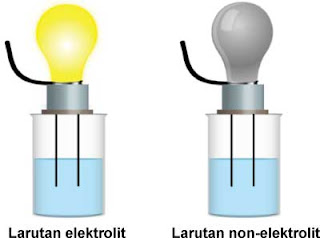
Berdasarkan hasil percobaan di atas, ada larutan yang dapat menyalakan lampu dan yang tidak dapat menyalakan lampu. Di antara larutan yang dapat menyalakan lampu, ada yang nyala lampunya terang dan yang nyala lampunya redup. Nyala lampu merupakan ciri bahwa larutan tersebut dapat menghantarkan arus listrik. Dengan demikian, larutan elektrolit dan nonelektrolit dapat dibedakan dengan mengamati nyala lampu.
Suatu larutan dikatakan larutan elektrolit jika larutan tersebut dapat menyalakan lampu. Sebaliknya, suatu larutan dikatakan larutan nonelektrolit jika larutan tersebut tidak dapat menyalakan lampu. Larutan elektrolit dapat dibagi dua, yaitu elektrolit kuat dan elektrolit lemah. Apakah perbedaan antara larutan elektrolit kuat dan elektrolit lemah?
Nyala lampu elektrolit kuat terang, sedangkan nyala lampu elektrolit lemah redup. Perbedaan antara larutan elektrolit dan larutan nonelektrolit dapat juga diamati dari ada tidaknya gelembung. Larutan elektrolit akan menghasilkan gelembung gas, sedangkan larutan nonelektrolit tidak menghasilkan gelembung gas.
Dapatkah Anda menyebutkan contoh-contoh dari larutan elektrolit kuat, elektrolit lemah, dan nonelektrolit? Pelajarilah tabel berikut.
Tabel Contoh-Contoh Larutan Elektrolit Kuat, Elektrolit Lemah, dan Nonelektrolit
Larutan
|
Elektrolit Kuat
|
Elektrolit Lemah
|
Nonelektrolit
|
Larutan garam dapur
|
√
| ||
Larutan asam asetat
|
√
| ||
Larutan asam klorida
|
√
| ||
Larutan gula 5%
|
√
| ||
Larutan alkohol
|
√
| ||
Larutan natrium hidroksida
|
√
|
Penyebab Larutan Elektrolit Dapat Menghantarkan Arus Listrik
Untuk mengetahui penyebab larutan elektrolit dapat menghantarkan arus listrik, kalian harus memahami terlebih dahulu konsep reaksi disosiasi (penguraian senyawa menjadi ion dalam larutan). Ketika suatu senyawa dilarutkan ke dalam air, ada tiga kemungkinan yang dapat terjadi, yaitu terdisosiasi (terurai) sempurna, terdisosiasi sebagian, dan tidak terdisosiasi.
Senyawa elektrolit kuat akan terdisosiasi sempurna, senyawa elektrolit lemah hanya terdisosiasi sebagian, sedangkan senyawa nonelektrolit tidak terdisosiasi. Suatu senyawa yang mengalami disosiasi, baik sempurna maupun sebagian terurai menjadi ion-ion penyusunnya (ion positif dan ion negatif). Reaksi-reaksi disosiasi pada senyawa elektrolit dapat dituliskan sebagai berikut.
HCl(l) → H+(aq) + Cl–(aq)
NaCl(s) → Na+(aq) + Cl–(aq)
CH3COOH(aq) → H+(aq) + CH3COO–(aq)
NaOH(s) → Na+(aq) + OH–(aq)
NH4OH(s) → NH4+(aq) + OH–(aq)
Daya hantar listrik larutan berhubungan dengan ion-ion dalam larutan. Aliran arus listrik berbentuk pergerakan partikel berupa partikel elektron maupun ion. Ketika dilewatkan ke dalam larutan elektrolit, arus listrik akan dihantarkan oleh ion-ion dalam larutan sehingga lampu dapat menyala. Semakin banyak ion-ion dalam larutan, daya hantar larutan semakin kuat.
Itulah sebabnya nyala lampu larutan elektrolit kuat lebih terang daripada larutan elektrolit lemah. Tahukah kalian, mengapa larutan nonelektrolit tidak dapat menghantarkan arus listrik? Ketika dilarutkan ke dalam air, larutan-larutan nonelektrolit seperti larutan gula dan alkohol tidak terurai menjadi ion-ionnya. Larutan nonelektrolit terurai menjadi molekul-molekulnya.
Hubungan antara Sifat Hantar Listrik dan Jenis Ikatan Kimia
Dalam artikel tentang ikatan kimia, telah dijelaskan mengenai ikatan ion dan ikatan kovalen. Senyawa yang memiliki ikatan ion disebut senyawa ionik, sedangkan senyawa yang memiliki ikatan kovalen disebut senyawa kovalen. Senyawa kovalen terbagi menjadi dua, yaitu senyawa kovalen polar dan nonpolar. Dengan menggambarkan struktur lewis ketujuh senyawa yang diuji pada percobaan di atas, maka kalian dapat mengetahui hubungan antara sifat daya hantar listrik dan jenis ikatan kimia.
Senyawa yang merupakan senyawa ionik adalah garam dapur (NaCl). Adapun asam asetat (CH3COOH), asam klorida (HCl), natrium hidroksida (NaOH), dan amonium hidroksida (NH4OH) merupakan contoh-contoh senyawa kovalen polar. Bagaimana dengan larutan gula dan alkohol? Kedua senyawa tersebut termasuk senyawa kovalen nonpolar. Berdasarkan hal tersebut dapat disimpulkan bahwa senyawa ionik dan kovalen polar merupakan senyawa elektrolit, sedangkan senyawa kovalen nonpolar merupakan senyawa nonelektrolit.
Kesimpulan
Dari penjelasan tentang uji daya hantar listrik, karakteristik dan penyebab larutan elektrolit dapat menghantarkan arus listrik sampai dengan hubungan antara daya hantar listrik dengan jenis ikatan kimia, maka dapat kita simpulkan beberapa hal mengenai perbedaan antara larutan elektrolit dan nonelektrolit, yaitu sebagai berikut.
Tabel Perbedaan Larutan Elektrolit dan Nonelektrolit
Larutan Elektrolit
|
Larutan Nonelektrolit
|
Dapat menghantarkan arus listrik.
|
Tidak dapat menghantarkan arus listrik.
|
Menimbulkan nyala lampu pada alat uji daya hantar listrik larutan.
|
Tidak menimbulkan nyala lampu pada alat uji daya hantar listrik larutan.
|
Menghasilkan gelembung gas pada alat uji elektrolit.
|
Tidak menghasilkan gelembung gas pada alat uji elektrolit.
|
Ketika dilarutkan dalam air, larutan elektrolit terurai menjadi ion.
|
Ketika dilarutkan dalam air, larutan nonelektrolit terurai menjadi molekul.
|
Ketika dilarutkan dalam air, akan terdisosiasi secara sempurna atau sebagian.
|
Ketika dilarutkan dalam air, tidak akan terdisosiasi.
|
Merupakan senyawa ionik atau kovalen polar.
|
Merupakan senyawa kovalen nonpolar.
|