Kekuatan Daya Hantar Listrik Larutan Elektrolit, Rumus Derajat Dissosiasi dan Ikatan Kimia
https://blogmipa-kimia.blogspot.com/2018/01/kekuatan-daya-hantar-listrik-larutan.html?m=0
Daftar Materi Kimia
Advertisement
Baca Juga:
Definisi Larutan
Larutan merupakan sistem homogen yang terdiri dari zat terlarut dan pelarut. Pelarut yang sering dipakai dalam melarutkan zat terlarut adalah air. Zat terlarut memiliki dua sifat berdasarkan perilakunya apabila arus listrik dialirkan. Sifat pertama, zat terlarut dapat menghantarkan arus listrik, sehingga larutan yang terbentuk mengalami perubahan kimia dan mampu menghantarkan arus listrik. Larutan tersebut dinamakan larutan elektrolit.
Sifat kedua, zat yang apabila dilarutkan ke dalam air tidak dapat menghantarkan arus listrik dan tidak ada perubahan kimia, sehingga larutan yang terbentuk dinamakan larutan nonelektrolit. Semua larutan anorganik, baik asam, basa, maupun garam memiliki sifat mampu menghantarkan arus listrik. Sedangkan semua larutan yang berasal dari zat organik seperti gula tebu, manosa, glukosa, gliserin, etanol, dan urea, tidak mampu menghantarkan arus listrik.
Daya Hantar Larutan
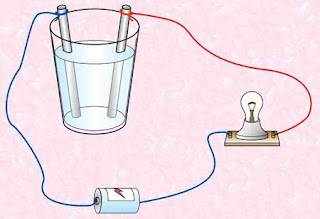
Air yang murni tidak akan menghantarkan listrik. Tetapi jika zat yang bersifat asam, basa, maupun garam telah dilarutkan di dalamnya, larutan yang dihasilkan akan mampu menghantarkan arus listrik. Secara sederhana, kemampuan suatu larutan untuk menghantarkan listrik dapat diuji dengan alat uji elektrolit.
Alat uji elektrolit tersebut terdiri atas sebuah bejana yang dihubungkan dengan dua buah elektrode. Elektrode-elektrode tersebut dihubungkan pada saklar dan lampu. Jika larutan elektrolit dimasukkan ke dalam bejana tersebut, lampu akan menyala. Sedangkan jika larutan nonelektrolit yang dimasukkan, lampu tidak akan menyala.
Arus listrik dalam larutan elektrolit dihantarkan oleh migrasi partikel-partikel bermuatan. Selain ditandai dengan menyalanya lampu, pada larutan elektrolit juga terdapat perubahan-perubahan kimia yang dapat diamati. Salah satu perubahan tersebut berupa timbulnya gelembung-gelembung gas, perubahan warna larutan, atau bahkan terbentuk endapan.
Tabel berikut menyajikan contoh pengujian daya hantar listrik dari beberapa larutan.
Tabel Daya Hantar Listrik Beberapa Larutan
Larutan
|
Rumus Senyawa
|
Nyala Lampu
|
Gelembung Gas
|
Air suling
|
H2O
|
-
|
-
|
Alkohol 70%
|
C2H5OH
|
-
|
-
|
Larutan hidrogen klorida
|
HCl
|
Terang
|
Ada
|
Larutan natrium hidroksida
|
NaOH
|
Terang
|
Ada
|
Larutan amonia
|
NH3
|
Terang
|
Ada
|
Larutan natrium klorida
|
NaCl
|
Terang
|
Ada
|
Larutan asam sulfat
|
H2SO4
|
Terang
|
Ada
|
Ekperimen Daya Hantar Listrik dari Larutan
Tujuan: Mengamati gejala-gejala hantaran arus listrik dalam berbagai larutan.
Alat dan Bahan
1. Gelas beker
2. Sumber listrik baterai
3. Kabel listrik
4. Lampu kecil
6. Batang karbon
7. Larutan garam dapur
8. Larutan cuka makanan
9. Larutan gula
10. Alkohol
Cara kerja:
1. Susunlah alat seperti gambar berikut ini.
2. Amati gejala apa yang timbul pada lampu dan ujung batang karbon saat saklar disambungkan untuk tiap-tiap larutan!
Hasil Pengamatan
Larutan
|
Gejala pada Bola Lampu
|
Gejala pada Batang Karbon
|
Air sumur
|
..........
|
..........
|
Garam
|
..........
|
..........
|
Cuka makanan
|
..........
|
..........
|
Gula
|
..........
|
..........
|
Kapur
|
..........
|
..........
|
Alkohol
|
..........
|
..........
|
Pertanyaan:
a. Larutan apa saja yang menunjukkan gejala timbulnya nyala pada bola lampu?
b. Larutan apa saja yang menunjukkan gejala timbulnya gelembung pada batang karbon?
c. Larutan apa saja yang tidak menunjukkan kedua gejala di atas?
Kesimpulan apa yang diperoleh dari percobaan ini?
Kekuatan Daya Hantar Larutan
Sebagaimana disebutkan di atas, bahwa arus listrik dalam larutan elektrolit dihantarkan oleh partikel-partikel bermuatan. Untuk menjelaskan fakta tersebut, Svante August Arrhenius (1884) mengemukakan teorinya tentang dissosiasi atau ionisasi elektrolit. Teori ini menyebutkan bahwa zat elektrolit apabila dilarutkan dalam air, akan berdissosiasi menjadi atom-atom atau gugus atom yang bermuatan.
Atom-atom atau gugus atom bermuatan tersebut merupakan ion-ion yang menghantarkan arus dalam elektrolit secara migrasi. Ion-ion tersebut bermuatan positif (kation) dan bermuatan negatif (anion) serta bergerak menuju elektrode yang muatannya berlawanan. Reaksi ionisasi atau dissosiasi elektrolit tersebut merupakan reaksi bolak-balik (reversible). Ionisasi elektrolit dapat dinyatakan dengan persamaan reaksi:
NaCl(aq) → Na+(aq) + Cl–(aq)
MgSO4(aq) → Mg2+(aq) + SO42–(aq)
CaCl2(aq) → Ca2+(aq) + 2Cl–(aq)
Na2SO4(aq) → 2Na+(aq) + SO42–(aq)
Oleh karena larutan harus bersifat netral, besarnya jumlah total muatan-muatan positif harus sama dengan muatan negatif dalam suatu larutan. Jumlah muatan yang dibawa oleh sebuah ion besarnya sama dengan valensi ion tersebut. Berdasarkan kemampuannya dalam menghantarkan arus listrik, larutan elektrolit dibagi menjadi dua macam, yaitu:
■ Larutan elektrolit kuat
Yaitu larutan yang memiliki daya hantar listrik besar. Larutan elektrolit kuat terionisasi sempurna di dalam air. Jika diuji dalam penguji elektrolit sederhana, lampu akan menyala terang. Contoh larutan elektrolit kuat antara lain larutan NaCl, KOH, H2SO4 , dan HCl.
■ Larutan elektrolit lemah
Yaitu larutan yang memiliki daya hantar kecil karena tidak semua zat terionisasi, atau hanya mengalami ionisasi sebagian. Jika diuji dengan penguji elektrolit sederhana, lampu akan menyala redup. Contoh larutan elektrolit lemah adalah larutan cuka dan amonia.
Derajat Dissosiasi
Larutan nonelektrolit tidak akan terionisasi dalam larutan. Proses ionisasi dipengaruhi oleh konsentrasi. Untuk membedakan larutan elektrolit dan nonelektrolit, dapat menggunakan derajat dissosiasi (α). Derajat dissosiasi adalah fraksi molekul yang benar-benar terdissosiasi. Atau dapat juga merupakan perbandingan mol zat terionisasi dengan mol zat mula-mula. Derajat dissosiasi dapat dinyatakan dengan rumus:
α
|
=
|
Mol zat terionisasi
|
Mol zat mula-mula
|
Nilai α dapat berubah-ubah, antara 0 dan 1, dengan ketentuan sebagai berikut.
● α = 1, larutan terdissosiasi sempurna = elektrolit kuat
● 0 < α < 1, larutan terdissosiasi sebagian = elektrolit lemah
● α = 0, larutan tidak terdissosiasi = nonelektrolit
Larutan Elektrolit dan Ikatan Kimia
Kemampuan untuk menghantarkan arus listrik tidak hanya dimiliki oleh senyawa ionik. Beberapa senyawa kovalen juga mampu menghantarkan listrik. Meski demikian, senyawa kovalen dan ionik memiliki beberapa perbedaan dalam menghantarkan arus listrik.
1. Senyawa Ionik
Senyawa ionik adalah senyawa yang atom-atomnya berikatan secara ionik. Ikatan ionik adalah ikatan yang dihasilkan dari perpindahan elektron dari satu atom ke atom lain. Satu atom memberikan satu atau lebih dari elektron terluarnya. Atom yang kehilangan elektron menjadi ion positif (kation) dan atom yang menerima elektron menjadi ion negatif (anion).
Dalam larutan, senyawa ionik akan terurai sempurna menjadi ion-ionnya yang bergerak bebas. Ion-ion itula yang menghantarkan arus listrik. Dalam larutan, senyawa ionik pada umumnya membentuk larutan elektrolit kuat.
Contoh:
NaCl(aq) ↔ Na+(aq) + Cl–(aq)
Ca(OH)2(aq) ↔ Ca2+(aq) + 2OH–(aq)
K2SO4(aq) ↔ 2K+(aq) + SO42–(aq)
KOH(aq) ↔ K+(aq) + OH–(aq)
2. Senyawa Kovalen
Senyawa kovalen adalah senyawa yang atom-atomnya berikatan secara kovalen. Ikatan kovalen terjadi akibat penggunaan bersama-sama pasangan elektron oleh dua atom. Senyawa kovalen nonpolar timbul karena perbedaan elektronegativitas antaratom yang sangat kecil, bahkan hampir sama. Sementara itu, senyawa kovalen polar timbul karena perbedaan elektronegativitas yang cukup besar antara dua atom. Hal tersebut menyebabkan salah satu atom lebih positif dan yang lain lebih negatif.
Larutan senyawa kovalen polar mampu menghantarkan arus listrik dengan baik. Hal tersebut terjadi karena senyawa kovalen polar dalam air akan terdissosiasi menjadi ion-ionnya.
Contoh:
HCl(aq) ↔ H+(aq) + Cl–(aq)
H2SO4(aq) ↔ 2H+(aq) + SO42–(aq)
Beberapa senyawa kovalen polar tidak terdissosiasi sempurna dalam pelarut air sehingga memiliki kemampuan daya hantar listrik yang rendah. Hal ini karena dalam pelarut air, hanya sedikit dari zat tersebut yang terdissosiasi membentuk ion.
Contoh:
NH3(aq) + H2O(l ) ↔ NH4+(aq) + OH–(aq)