Model Atom Dalton, Thomson, Rutherford, Bohr, Mekanika Kuantum Beserta Kelebihan dan Kelemahannya
https://blogmipa-kimia.blogspot.com/2017/04/model-model-atom-kekurangan-dan-kelebihannya.html
Daftar Materi Kimia
Advertisement
Baca Juga:
Semua partikel yang terdapat di
alam semesta tersusun atas partike-partikel yang sangat kecil yang kemudian
para ahli kimia menyebutnya dengan nama Atom.
Sejak zaman dahulu dimana manusia mulai berfikir tentang zat penyusun setiap
materi, kemudian dirumuskannya teori atom, sampai zaman canggih seperti
sekarang ini, keberadaan atom sudah diterima oleh semua orang. Namun bentuk
atom dan penyusunnya belum diketahui secara pasti
Para ahli kimia hanya bisa
mereka-reka berdasarkan hasil pengamatan di laboratorium terhadap gejala yang
ditimbulkan jika suatu materi diberi perlakuan tertentu. Dari pengamatan
gejala-gejala tersebut, para ilmuwan membuat teori tentang atom serta
memperkirakan bentuk atom tersebut dengan nama Model
Atom.
Model-model atom yang dibuat oleh
para ilmuwan mengalami perkembangan sampai sekarang dan mungkin akan terus
berkembang seiring dengan perkembangan IPTEK. Berikut ini adalah gambar
perkembangan model-model atom yang dikembangkan oleh para ahli kimia kimia.
 |
| Perkembangan Teori Atom |
Berdasarkan konsep atom Democritus sesuai dengna Hukum Kekekalan Massa yang berbunyi “massa zat sebelum dan sesudah reaksi sama” dan Hukum Perbandingan Tetap yang berbunyi “perbandingan massa unsur-unsur dalam suatu senyawa adalah
tetap dan tertentu”, maka pada tahun 1803 ilmuwan Inggris John Dalton merumuskan teori model atom
sebagai berikut:
1. Atom
merupakan bagian terkecil dari materi yang sudah tidak dapat dibagi lagi.
2. Atom
digambarkan sebagai bola pejal yang sangat kecil, suatu unsur memiliki
atom-atom yang identik dan berbeda untuk unsur yang berbeda.
3. Atom-atom
bergabung membentuk senyawa dengan perbandingan bilangan bulat dan sederhana.
Misalnya air terdiri atas atom-atom hidrogen dan atom-atom oksigen.
4. Reaksi
kimia merupakan pemisahan atau penggabungan atau penyusunan kembali dari atom-atom,
sehingga atom tidak dapat diciptakan atau dimusnahkan
Hipotesis Dalton digambarkan dengan
model atom sebagai bola pejal
seperti bola tolak peluru. Kelebihan dan kelemahan model atom Dalton antara
lain sebagai berikut:
Kelebihan
-
Dapat menerangkan Hukum Kekekalan Massa (Hukum Lavoisier)
-
Dapat menerangkan Hukum Perbandingan Tetap (Hukum Proust)
Kelemahan
-
Tidak dapat menerangkan sifat listrik atom
-
Pada kenyataannya atom dapat dibagi lagi menjadi
partikel yang lebih kecil (partikel
subatomik)
Model Atom Thomson
pada tahun 1897, fisikawan Inggris,
Joseph John Thomson menemukan elektron . dia menunjukkan bahwa
elektron adalah partikel subatomik. Dari penemuan ini Thomson mengemukakan
hipotesis sebagai berikut: “karena elektron bermuatan listrik negatif, sedangkan atom
bermuatan listrik netral, maka harus ada muatan listrik positif yang
mengimbangi muatan elektron dalam atom”.
Berdasarkan hipotesis tersebut,
Thomson mengusulkan model atomnya yang dikenal dengan nama model atom roti kismis yaitu sebagai berikut:
1. Atom
berbentuk bola pejal bermuatan positif yang homogen (diibaratkan seperti roti)
2. Elektron
bermuatan negatif tersebar di dalamnya (seperti kismis yang tersebar di dalam
roti).
Beberapa kelebihan dan kelemahan
model atom Thomson adalah sebagai berikut:
Kelebihan
1. Dapat
menerangkan adanya partikel yang lebih kecil dari atom yang disebut partikel
subatomik.
2. Dapat
menerangkan sifat listrik atom.
KelemahanTidak dapat menerangkan fenomena penghamburan partikel alfa oleh selaput tipis emas yang dikemukakan oleh Rutherford.
Model Atom Rutherford
Tahun 1911, Fisikawan Inggris Ernest Rutherford dan 2 temannya Geiger dan Marsden melakukan eksperimen “penghamburan partikel alfa oleh selaput tipis emas (0,0004
mm)” dengan hasil sebagai berikut:
1. Sebagian besar
partikel alfa menembus selaput tipis emas. Berarti, sebagian besar
atom adalah ruang kosong.
2. Sedikit dari
partikel alfa (yang bermuatan positif) dibelokkan keluar oleh sesuatu.
hal ini menunjukkan adanya sesuatu yang bermuatan positif yang dapat
membelokkan partikel alfa.
3. Lebih sedikit
lagi dari partikel alfa itu (hanya 1 dari 20.000) terpantul dari selaput tipis
emas. Hal ini menunjukkan adanya sesuatu yang sangat kecil
(belakangan disebut sebagai inti), namun massa terpusat di sana sehingga
partikel alfa yang menumbuk pusat massa itu akan terpantulkan
Dari fenomena percobaan tersebut,
Rutherford mengusulkan model atom yang dikenal dengan model atom nuklir Rutherford, yaitu sebagai berikut:
1. Sebagian
besar ruangan dalam atom merupakan ruangan kosong.
2. Atom terdiri atas inti atom bermuatan positif
dan hampir seluruh massa atom terpusat pada inti.
3. Elektron
beredar mengelilingi inti.
4. Jumlah
muatan inti sama dengan jumlah muatan elektron sehingga atom bersifat netral.
Beberapa kelebihan dan kelemahan
model atom Rutherford adalah sebagai berikut:
Kelebihan
1. Dapat
menerangkan fenomena penghamburan partikel alfa oleh selaput tipis emas.
2. Mengemukakan
keberadaan inti atom yang bermuatan positif dan merupakan pusat massa atom.
Kelemahan
1. Bertentangan
dengan teori elektron dinamika klasik, di mana suatu partikel bermuatan listrik
apabila bergerak akan memancarkan energi.
2. Elektron
bermuatan negatif yang beredar mengelilingi inti akan kehilangan energi
terus-menerus sehingga akhirnya akan membentuk lintasan spiral dan jatuh ke
inti. Pada kenyataannya hal ini tidak terjadi, elektron tetap stabil pada
lintasannya.
Model Atom Niels Bohr
Tahun 1913 fisikawan Denmark, Niels Henrik David Bohr, mengemukakan
teori tentang atom yang bertitik tolak dari model atom nuklir Rutherford dan teori kuantum Planck.
Model atom Bohr berdasarkan
teorinya adalah sebagai berikut:
1. Elektron
beredar mengelilingi inti pada lintasan-lintasan (orbit) tertentu.
2. Elektron
yang beredar pada lintasannya tidak memancarkan energi, lintasan elektron ini
disebut lintasan stasioner.
3. Apabila
elektron dengan tingkat energi rendah pindah ke lintasan dengan tingkat energi
lebih tinggi maka elektron akan menyerap energi, peristiwa ini disebut eksitasi. Sebaliknya, apabila elektron
pindah dari lintasan dengan tingkat energi lebih tinggi ke lintasan dengan
tingkat energi lebih rendah maka elektron akan memancarkan energi, peristiwa ini
disebut deeksitasi.
Baik eksitasi maupun deeksitasi disebut peristiwa transisi elektron. Energi yang diserap
atau dipancarkan pada peristiwa transisi elektron ini dinyatakan dengan
persamaan:
4. Energi
yang dipancarkan/diserap ketika terjadi transisi elektron terekam sebagai
spektrum atom.
Beberapa kelebihan dan kelemahan
model atom Bohr adalah sebagai berikut:
Kelebihan
1. Menjawab
kelemahan dalam model atom Rutherford dengan mengaplikasikan teori kuantum.
2. Menerangkan
dengan jelas garis spektrum pancaran (emisi) atau serapan (absorpsi) dari atom
hidrogen.
Kelemahan
1. Terjadi
penyimpangan untuk atom yang lebih besar dari hidrogen.
2. Tidak
dapat menerangkan efek Zaeman, yaitu
spektrum atom yang lebih rumit apabila atom ditempatkan pada medan magnet.
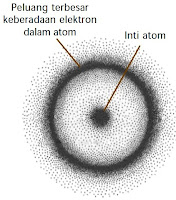
Model Atom Mekanika Kuantum
Model atom mekanika kuantum
dikemukakan oleh Erwin Schrodinger.
Model ini dapat digunakan untuk menjelaskan atom hidrogen dan atom yang lain.
Menurut teori mekanika kuantum, elektron dalam mengelilingi inti terletak pada tingkat-tingkat tertentu. Akan tetapi, keberadaan elektron tidak dapat dipastikan kedudukannya secara tepat. Adapun yang dapat dipastikan hanyalah kebolehjadian menemukan elektron. Daerah atau ruang kebolehjadian menemukan elektron disebut orbital.
Erwin Schrodinger mendasarkan model
atomnya pada hipotesis de Broglie mengenai dualisme partikel dan
ketidakpastian Heisenberg.
Menurut Louis de Broglie, cahaya
memiliki sifat partikel dan sifat cahaya. Sifat partikel ditandai dengan
memiliki massa. Sifat cahaya ditandai dengan memiliki sifat gelombang dalam
gerakannya. Dengan demikian, elektron yang memiliki massa dapat dipandang
sebagai partikel dan cahaya. Akibat dualisme elektron, Heisenberg mengajukan
prinsip ketidakpastian.
Menurut Heisenberg, tidak ada
metode yang dapat digunakan untuk menentukan kedudukan elektron. Akan tetapi,
yang dapat ditentukan adalah kebolehjadian menemukan elektron. Erwin
Schrodinger memperoleh hadiah Nobel 1933 bidang fisika bersama Paul Dirac,
seorang fisikawan lain, untuk karya perintis mereka dalam mekanika kuantum.
Demikianlah artikel tentang sejarah
perkembangan teori atom, model atom Dalton, Thomson, Rutherford, Bohr dan
Mekanika Kuantum (model atom modern). Semoga dapat bermanfaat untuk Anda. Terimakasih
atas kunjungannya dan sampai jumpa di artikel selanjutnya.






Terima kasih banyak... saya sangat terbantu
ReplyDeletesama-sama
DeleteSangat membantu! Terima kasih banyak!
ReplyDeleteterima kasih, bisa untuk bahan diskusi anak-anak
ReplyDeleteSangat bermanfaat sekali. Terimakasih
ReplyDeleteMantapp jiwaa
ReplyDeleteMakasih banget yang buat ini. Jadi gampang ngerjain tugas kimia. Makasih yang sedalam dalamnya dari saya
ReplyDeleteTolong lebih lengkap lg ya soalnya anak saya tanya reproduksi wanita
ReplyDeleteIni materi kimia bukan biologi bro!
DeleteNyasar bro?
DeleteAnda sehat?
DeleteGua ikutan bole?🤣
DeleteThank you :)
ReplyDeleteyou are welcome...
DeleteOk mksh tot
ReplyDeletenice,mantullllll
ReplyDeleteTerima kasih
ReplyDeleteThx
ReplyDelete❤❤
ReplyDeleteBukan kaleng kaleng penjelasan x
ReplyDeleteThanks on the information, itu is very useful
ReplyDeleteTeori atom modern kok nggak ada bro
ReplyDeleteItu teori mekanika kuantum sama dengan teori atom modern
DeleteGambarnya salah pak nilai kimia saya jd jelek
ReplyDeletegambar mana yang salah itu?
DeleteOk mantap kali
ReplyDeleteTeori nya max plank blom masuk tuh
ReplyDeleteIzin save
ReplyDeleteTeori atom rutherford gambarnya salah pak
ReplyDeletesip mamank
ReplyDeleteYo mksh
ReplyDeleteItu kan harusnya model nya Thomson kok di situ tertulis rutherRuth
ReplyDeleteTerimakasih koreksinya, keterangan gambar akan segera diperbaiki
Deleteok thanks
ReplyDeleteMekanika gelombang tidak ada?
ReplyDeleteTeori mekanika gelombang kok nggak ada kak?
ReplyDelete