Kelebihan dan Kelemahan Model Atom Dalton, Thomson, Rutherford dan Niels Bohr
https://blogmipa-kimia.blogspot.com/2018/03/kelebihan-dan-kelemahan-model-atom.html?m=0
Daftar Materi Kimia
Advertisement
Baca Juga:
Model Atom Dalton
Model atom yang dikemukakan oleh John Dalton adalah sebagai berikut.
■ Atom merupakan bagian terkecil dari materi yang sudah tidak dapat dibagi lagi.
■ Atom digambarkan sebagai bola pejal yang sangat kecil, suatu unsur memiliki atom-atom yang identik dan berbeda untuk unsur yang berbeda.
■ Atom-atom bergabung membentuk senyawa dengan perbandingan bilangan bulat dan sederhana. Misalnya air terdiri atas atom-atom hidrogen dan atom-atom oksigen.
■ Reaksi kimia merupakan pemisahan atau penggabungan atau penyusunan kembali dari atomatom, sehingga atom tidak dapat diciptakan atau dimusnahkan.
Model Atom Thomson
Pada tahun 1897, fisikawan Inggris, Joseph John Thomson menemukan elektron. dia menunjukkan bahwa elektron adalah partikel subatomik. Dari penemuan ini Thomson mengemukakan hipotesis sebagai berikut: “karena elektron bermuatan listrik negatif, sedangkan atom bermuatan listrik netral, maka harus ada muatan listrik positif yang mengimbangi muatan elektron dalam atom”.
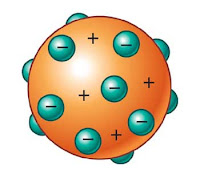
Berdasarkan hipotesis tersebut, Thomson mengusulkan model atomnya yang dikenal dengan nama model atom roti kismis yaitu sebagai berikut:
■ Atom berbentuk bola pejal bermuatan positif yang homogen (diibaratkan seperti roti)
■ Elektron bermuatan negatif tersebar di dalamnya (seperti kismis yang tersebar di dalam roti).
Model Atom Rutherford
Model atom yang dikemukakan oleh Ernest Rutherford adalah sebagai berikut.
■ Sebagian besar ruangan dalam atom merupakan ruangan kosong.
■ Atom terdiri atas inti atom bermuatan positif dan hampir seluruh massa atom terpusat pada inti.
■ Elektron beredar mengelilingi inti.
■ Jumlah muatan inti sama dengan jumlah muatan elektron sehingga atom bersifat netral.
Model Atom Niels Bohr
Model atom yang dikemukakan oleh Niels Bohr adalah sebagai berikut.
■ Atom terdiri atas inti yang bermuatan positif dan dikelilingi oleh elektron yang bermuatan negatif di dalam suatu lintasan.
■ Elektron dapat berpindah dari satu lintasan ke yang lain dengan menyerap atau memancarkan energi sehingga energi elektron atom itu tidak akan berkurang. Jika berpindah lintasan ke lintasan yang lebih tinggi, elektron akan menyerap energi. Jika beralih ke lintasan yang lebih rendah, elektron akan memancarkan energi.
■ Kedudukan elektron-elektron pada tingkat-tingkat energi tertentu yang disebut kulit-kulit elektron.
Kelebihan dan Kelemahan Model Atom Menurut Para Ilmuwan
Kelebihan dan kelemahan dari masing-masing model atom dari mulai model atom Dalton sampai dengan model atom Niels Bohr.
Model Atom
|
Kelebihan
|
Kelemahan
|
Menurut Dalton seperti bola pejal.
|
Mulai membangkitkan minat terhadap penelitian mengenai model atom.
|
Tidak menerangkan hubungan antara larutan senyawa dan daya hantar arus listrik, jika atom merupakan bagian terkecil dari suatu unsur dan tidak dapat dibagi lagi.
|
Menurut Thomson seperti roti kismis.
|
Membuktikan adanya partikel lain yang bermuatan negatif dalam atom. Berarti atom bukan merupakan bagian terkecil dari suatu unsur. Selain itu juga memastikan bahwa atom tersusun dari partikel yang bermuatan positif dan negatif untuk membentuk atom netral. Juga membuktikan bahwa elektron terdapat dalam semua unsur.
|
Belum dapat menerangkan bagaimana susunan muatan positif dan jumlah elektron dalam bola.
|
Rutherford seperti planet bumi mengelilingi matahari.
|
Membuat hipotesa bahwa atom tersusun dari inti atom dan elektron yang mengelilingi inti dan satu sama lain terpisah oleh ruang hampa.
|
Model tersebut tidak dapat menerangkan mengapa elektron tidak pernah jatuh ke dalam inti sesuai dengan teori fisika klasik.
|
Niels Bohr seperti bola, dengan inti atom yang dikeliling, sejumlah elektron.
|
Mampu membuktikan adanya lintasan elektron untuk atom hidrogen dengan jari-jari bola:
= 0,529 Angstrom
= 0,529 × 10–10 m
= 1 bohr
Bohr-sommerfeld mengembangkan orbit Bohr (bola) menjadi orbital yaitu fungsi gelombang elektron atau identitas elektron sebagai gelombang yang memiliki bentuk bola (l = 0, orbital s) atau 1 bola, (l = 1, orbital p) atau 2 balon terpilin, (l = 2, orbital d) atau 3 balon terpilin, (l = 3, orbital f).
|
Hanya dapat menerangkan atom-atom yang memiliki elektron tunggal seperti gas hidrogen, tetapi tidak dapat menerangkan spektrum warna dari atom-atom yang memiliki banyak elektron.
|