Persamaan Reaksi: Definisi, Bagian, Cara Penulisan, Contoh Soal dan Pembahasan
https://blogmipa-kimia.blogspot.com/2017/08/pengertian-dan-cara-penulisan-persamaan-reaksi-kimia.html
Daftar Materi Kimia
Advertisement
Baca Juga:
Kajian utama dalam ilmu Kimia adalah mempelajari perubahan materi atau reaksi kimia. Agar reaksi kimia yang terjadi mudah dikomunikasikan, maka digunakanlah suatu lambang dan zat-zat yang terlibat dalam reaksi kimia yang dinyatakan dalam bentuk persamaan kimia atau persamaan reaksi. Lalu tahukah kalian apa yang dimaksud dengan persamaan reaksi? Bagaimana cara penulisan suatu reaksi kimia? Kalian akan dengan mudah memahaminya setelah mempelajari penjelasan berikut ini.
Pengertian Persamaan Reaksi
Persamaan reaksi didefinisikan sebagai persamaan yang menyatakan kesetaraan jumlah zat-zat yang terlibat dalam reaksi kimia dengan menggunakan rumus kimia. Dalam reaksi kimia terdapat zat-zat pereaksi (reaktan) dan zat-zat hasil reaksi (produk). Di dalam persamaan reaksi, rumus kimia pereaksi dituliskan di ruas kiri dan rumus kimia hasil reaksi dituliskan di ruas kanan. Antara kedua ruas itu dihubungkan dengan anak panah (→) yang menyatakan arah reaksi kimia.
Contoh:
Logam magnesium bereaksi dengan gas klorin membentuk magnesium klorida. Tuliskan persamaan reaksinya.
Persamaan reaksinya adalah Mg + Cl2 → MgCl2
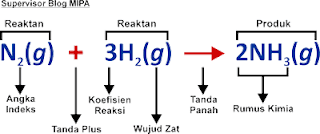
Bagian-Bagian Persamaan Reaksi
Suatu persamaan reaksi kimia dapat ditulis dengan dua cara yaitu persamaan perkataan dan persamaan simbol. Persamaan perkataan adalah persamaan kimia yang memberi nama pereaksi-pereaksi dan nama hasil reaksinya, misalnya gas nitrogen bereaksi dengan gas hidrogen menghasilkan amonia, maka persamaan perkataannya adalah sebagai berikut.
Sedangkan persamaan simbol adalah suatu singkatan dalam menguraikan suatu reaksi kimia. Simbol ini menggunakan rumus kimia dari pereaksi-pereaksi dan hasil reaksi, serta menggunakan tanda plus (+) dan tanda panah (→). Sebagai contoh, persamaan perkataan dari reaksi kimia antara nitrogen dan hidrogen di atas, maka kita dapat menuliskan persamaan simbolnya sebagai berikut.
Dari persamaan perkataan dan persamaan simbol di atas, maka dapat kita ketahui bagian-bagian dari sebuah persamaan reaksi, yaitu sebagai berikut.
#1 Rumus Kimia
Rumus kimia yaitu rumus kimia dari pereaksi dan hasil reaksi. Dalam persamaan reaksi di atas, pereaksinya adalah nitrogen (N2) dan hidrogen (H2) sedangkan hasil reaksinya adalah amonia (NH3).
#2 Wujud Zat
Wujud zat yaitu huruf menyatakan keadaan atau wujud zat (fase) saat bereaksi. Meskipun bukan sebuah keharusan, terkadang kita perlu mencantumkan wujud zat-zat yang terlibat dalam suatu reaksi. Wujud zat ditulis dengan singkatan dalam tanda kurung dibelakang rumus kimia dari zat yang bersangkutan.
Tabel Penulisan Wujud Zat
Simbol
|
Singkatan
|
Wujud Zat
|
g
|
gas
|
zat berwujud gas
|
l
|
liquid
|
zat berwujud cair
|
s
|
solid
|
zat berwujud padat
|
aq
|
aques
|
zat berwujud larutan
|
#3 Koefisien Reaksi
Koefisien reaksi menyatakan jumlah partikel dari setiap pereaksi dan produk reaksi. Pada contoh persamaan reaksi di atas, 1 molekul N2 bereaksi dengan 3 molekul H2 menghasilkan 2 molekul NH3. Koefisien 1 umumnya tidak perlu dituliskan. Koefisien reaksi diberikan agar persamaan reaksi sesuai dengan Hukum Kekekalan Massa dari Lavoisier, yang menyatakan bahwa:
“Massa zat sebelum dan sesudah reaksi adalah sama”
Karena massa suatu zat berbanding lurus dengan jumlah partikel (atom), maka hukum tersebut dapat pula berarti sebagai berikut
Jumlah atom dari setiap unsur di ruas kiri
|
=
|
Jumlah atom dari setiap unsur di ruas kanan
|
#4 Angka Indeks
Angka indeks yaitu angka kecil yang menjorok ke bawah di belakang atom atau ion. Angka ini berfungsi untuk menunjukkan jumlah atom atau ion dalam suatu molekul atau senyawa kimia.
Contoh:
Dalam Al2(SO4)3, angka indeks Al = 2 dan SO4 = 3.
Dalam NH3, angka indeks N = 1 dan H = 3.
#5 Tanda Plus dan Anak Panah
Tanda plus (+) dibaca “bereaksi dengan” sedangkan tanda panah menunjukkan arah reaksi dan dapat dibaca “membentuk” atau “menghasilkan”.
Cara Penulisan Persamaan Reaksi
Dalam mempelajari kimia, diperlukan adanya suatu persamaan reaksi kimia sebagai simbol adanya suatu reaksi kimia. Penulisan persamaan reaksi membutuhkan aspek kuantitatif dan juga aspek kualitatif. Lalu apa saja aspek kuantitatif dan kualitatif tersebut?
#1 Aspek Kuantitatif
Aspek kuantitatif diperlukan dalam menyetarakan koefisien pereaksi dan hasil reaksi berdasarkan hukum kekekalan massa, yaitu jumlah massa sebelum reaksi sama dengan jumlah massa sesudah reaksi. Dengan demikian, reaksi dapat menunjukkan jumlah setiap zat yang terlibat dalam reaksi. Satu mol adalah banyaknya zat yang mengandung partikel-partikel zat itu sebanyak atom yang terkandung dalam 12 gram 12C sebanyak 6,023 × 1023 (tetapan Avogrado).
Contoh:
Persamaan reaksi antara hidrogen dan oksigen adalah sebagai berikut.
2H2(g) + O2(g) → 2H2O(g)
Persamaan reaksi kimia tersebut menunjukkan bahwa “2 mol hidrogen bereaksi dengan 1 mol oksigen menghasilkan 2 mol air”.
#2 Aspek Kualitatif
Aspek kualitatif diperlukan dalam memberi tanda (simbol) sifat fisik dari pereaksi-pereaksi dan hasil reaksi, yaitu:
1) untuk zat padatan diberi simbol solid (s);
2) untuk zat cair diberi simbol liquid (l);
3) untuk zat bentuk gas diberi simbol gases (g); dan
4) untuk zat larutan diberi simbol aqueous (aq).
Langkah-langkah penulisan suatu persamaan reaksi dapat ditulis sebagai berikut. Misalkan dari persamaan perkataan:
klorin + kalium bromida → kalium klorida + bromin
Tabel Langkah-Langkah Penulisan Persamaan Reaksi Kimia
No.
|
Langkah-Langkah
|
Hasil
| ||
1
|
Tentukan rumus kimia dari pereaksi dan hasil reaksi
|
Pereaksi = Cl2; KBr
Hasil reaksi = KCl; Br2
| ||
2
|
Tuliskan persamaan reaksinya
|
Cl2 + KBr → KCl + Br2
| ||
3
|
Hitung jumlah atom setiap unsur
|
Atom Cl = 2
|
Sebelah kiri
(pereaksi)
| |
Atom K = 1
| ||||
Atom Br = 1
| ||||
Atom Cl = 1
|
Sebelah kanan
(hasil reaksi)
| |||
Atom K = 1
| ||||
Atom Br = 2
| ||||
4
|
Setarakan jumlah atom setiap unsur pereaksi (kiri) dan hasil reaksi (kanan)
|
•
|
Jumlah atom Cl disetarakan terlebih dahulu dengan menulis 2 di depan KCl:
Cl2 + KBr → 2KCl + Br2
| |
•
|
Jumlah atom Br selanjutnya disetarakan dengan menulis 2 di depan KBr:
Cl2 + 2KBr → 2KCl + Br2
| |||
5
|
Tuliskan tanda keadaan fisik dari setiap senyawa
|
Cl2(g)+ 2KBr(aq) → 2KCl(aq) + Br2(l)
| ||
Contoh Soal dan Pembahasan Persamaan Reaksi
Contoh Soal #1
Tentukanlah koefisien reaksi dari asam nitrat dan hidrogen sulfida menghasilkan nitorgen oksida, sulfur, dan air. Persamaan reaksinya dapat ditulis sebagai berikut:
HNO3(aq) + H2S(g) → NO(g) + S(s) + H2O(l )
Jawab:
Cara yang termudah untuk menentukan koefisien reaksinya adalah dengan memisalkan koefisiennya masing-masing a, b, c, d dan e sehingga:
aHNO3 + bH2S → cNO + dS + eH2O
Berdasarkan reaksi di atas:
Jumlah atom N
Ruas kiri = a
Ruas kanan = c
Ruas kiri = ruas kanan, maka
a = c ………. Pers. (1)
Jumlah atom O
Ruas kiri = 3a
Ruas kanan = c + e
Ruas kiri = ruas kanan
3a = c + e ………. Pers. (2)
Kita subtitusikan persamaan (1) ke dalam persamaan (2)
3c = c + e
e = 3c – c
e = 2c ………. Pers. (3)
Jumlah atom H
Ruas kiri = a + 2b
Ruas kanan = 2e
Ruas kiri = ruas kanan
a + 2b = 2e ………. Pers. (4)
Kita subtitusikan persamaan (3) ke persamaan (4)
a + 2b = 2(2c)
a + 2b = 4c ………. Pers. (5)
Kita subtitusikan persamaan (1) ke persamaan (5)
a + 2b = 4a
2b = 4a – a
2b = 3a
b = 3/2 a ………. Pers. (6)
Jumlah atom S
Ruas kiri = b
Ruas kanan = d
Ruas kiri = ruas kanan
b = d ………. Pers. (7)
Kita subtitusikan persamaan (6) ke persamaan (7)
3/2 a = d
d = 3/2 a ………. Pers. (8)
Maka agar terselesaikan diambil sembarang harga misalnya a = 2, maka c = 2, b = d = 3, dan e = 4 sehingga persamaan reaksinya adalah sebagai berikut:
2HNO3 + 3H2S → 2NO + 3S + 4H2O
Persamaan reaksi di atas dapat dibaca: dua senyawa asam nitrat dan tiga senyawa hidrogen sulfida akan menghasilkan dua senyawa nitrogen oksida, tiga atom sulfur dan empat molekul air.
Contoh Soal #2
Tuliskan dan setarakan persamaan reaksi antara logam aluminium yang bereaksi dengan larutan asam sulfat membentuk larutan aluminium sulfat dan gas hidrogen!
Jawab:
Cara mudah untuk menuliskan dan menyetarakan persamaan reaksi, ikuti langkah-langkah seperti yang telah disajikan dalam tabel penulisan persamaan reaksi di atas.
Langkah #1, menentukan rumus kimia pereaksi dan hasil reaksi
Pereaksi = Al; H2SO4
Hasil reaksi = Al2(SO4)3; H2
Langkah #2, menuliskan persamaan reaksinya
Al + H2SO4 → Al2(SO4)3 + H2
Langkah #3, menghitung jumlah atom setiap unsur
Jumlah atom di ruas kiri
Al = 1
H = 2
S = 1
O = 4
Jumlah atom di ruas kanan
Al = 2
H = 2
S = 3
O = 12
Langkah #4, menyetarakan jumlah atom setiap unsur pereaksi dan hasil reaksi
a)Letakkan koefisien 2 di depan Al, sehingga jumlah atom Al di ruas kiri menjadi 1 × 2 = 2 buah Al (setara dengan jumlah Al di ruas kanan).
b)Kemudian, letakkan koefisien 3 di depan H2SO4, sehingga di ruas kiri jumlah atom H menjadi 6, atom S menjadi 3, dan jumlah atom O menjadi 12. Pada tahap ini, jumlah atom S dan O ruas kiri sudah sama dengan ruas kanan, sedangkan atom H ruas kanan belum setara dengan ruas kiri.
c)Letakkan koefisien 3 di depan H2, sehingga jumlah atom H ruas kanan menjadi 6, setara dengan ruas kiri.
Langkah #5, menuliskan persamaan reaksi yang sudah setara lengkap dengan wujud fisik setiap senyawa
2Al(s) + 3H2SO4(aq) → Al2(SO4)3(aq) + 3H2(g)
Demikianlah artikel tentang pengertian, bagian-bagian dan aturan penulisan persamaan reaksi kimia beserta contoh soal cara menentukan koefisien reaksi dan penyetaraan persamaan reaksi. Semoga dapat bermanfaat untuk Anda. Apabila terdapat kesalahan tanda, simbol, huruf maupun angka dalam perhitungan mohon dimaklumi. Terimakasih atas kunjungannya dan sampai jumpa di artikel berikutnya.